Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi nFe2O3=a(mol) nCuO=b(mol) Sau khi cho qua H2 dư=> nFe=2a n Cu=b
Áp dụng bảo toàn e: nSO2=(6a+2b)/2=3a+b(mol)
m tăng= 56. 2a+ 64b-(3a+b)32=7,2 (1)
m hh ban đầu= 160a + 80b= 24(2)
Từ (1) và (2) ta được a=0,05 b=0,2
=> mFe =2,8(g) mCu=12,8(g)

Đặt nZn = x mol; nFe = y mol.
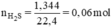
Ta có hệ phương trình: 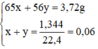
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Oxit: MO.
Gọi: nCuO = a (mol) → nMO = 2a (mol)
⇒ 80a + (MM + 16).2a = 3,6 (1)
Có: nHNO3 = 0,06.2,5 = 0,15 (mol)
BTNT Cu: nCu(NO3)2 = nCu = a (mol)
BTNT M: nM(NO3)2 = nM = 2a (mol)
BT e, có: 2nCu = 3nNO \(\Rightarrow n_{NO}=\dfrac{2}{3}n_{Cu}=\dfrac{2}{3}a\left(mol\right)\)
BTNT N, có: \(2n_{Cu\left(NO_3\right)_2}+2n_{M\left(NO_3\right)_2}+n_{NO}=n_{HNO_3}\)
\(\Rightarrow2a+2.2a+\dfrac{2}{3}a=0,15\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,0225\left(mol\right)\\M_M=24\left(g/mol\right)\end{matrix}\right.\)
→ M là Mg.
Đáp án: B

\(PTHH:\)
\(Fe_3O_4+4CO\rightarrow3Fe+4CO_2\uparrow\)
\(CuO+CO\rightarrow Cu+CO_2\uparrow\)
\(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\)
Gọi số mol \(Fe_3O_4;CuO\) lần lượt là \(x;y\)
\(m_{kl}=m_{Fe}+m_{Cu}=168x+64y=2,32\left(g\right)\left(1\right)\)
\(n_{\downarrow}=n_{CaCO_3}=\frac{5}{100}=0,05\left(mol\right)\)
\(\Leftrightarrow4x+y=0,05\left(mol\right)\left(2\right)\)
Giải hệ hai phương trình \(\left(1\right);\left(2\right)\) ta được \(n_{Fe_3O_4}=n_{CuO}=0,01\left(mol\right)\)
\(\Rightarrow m_{Fe_3O_4}=0,01.232=2,32\left(g\right);m_{CuO}=0,01.80=0,8\left(g\right)\)

Theo đề bài ta có bột S dư nên Fe, Zn tác dụng hết với S.
a)Phương trình hóa học của phản ứng.
Zn + S -> ZnS Fe + S -> FeS
x mol x mol y mol y mol
ZnSO4 + H2SO4 -> ZnSO4 + H2S
x mol x mol
FeSO4 + H2SO4 -> FeSO4 + H2S
x mol y mol
Ta có hệ phương trình :
Giải hệ phương trình => x = 0,04 (mol), y = 0,02 (mol).
Vậy mZn = 0,04.65 = 2,6g
mFe = 0,02.56 = 1,12g.

a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12VV

Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
n H2=\(\dfrac{2,24}{22,4}\)=0,1 mol
- Nếu Zn tan hết
2Na + 2H2O --> 2NaOH + H2
a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
2b<----b-------------------->b
->\(\left\{{}\begin{matrix}2b\text{≤}a\\0,5a+b=14,3\end{matrix}\right.\) loại
=> Zn không tan hết => NaOH hết
PT:2Na + 2H2O --> 2NaOH + H2
a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
\ a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)
PTP. ứng:
Fe+S----> FeS
Fe+ 2HCl--> FeCl2+H2
x x (mol)
FeS+ 2HCl--> FeCl2+ H2S
y y (mol)
Gọi n H2 và H2S trong C lần lượt là x và y mol, ta có hpt:
x+y=0.1
(2x+32y)/2(x+y)=13
--> x=0.02, y=0.08
--> tổng m Fe+n FeS= n Fe tỏng A=x+y=0.1 mol
m Fe=0.1.56=5.6 (g)

\(n_{CaCO_3}=n_{CO_2}=\dfrac{5}{100}=0.05\left(mol\right)\)
\(\Rightarrow n_O=0.05\left(mol\right)\)
\(m_{oxit}=m_{cr}+m_O=3.04+0.05\cdot16=3.84\left(g\right)\)