
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



1) + Cho hỗn hợp tác dụng với dd HCl:
Ag2O + HCl ----> AgCl + H2O
MgO + 2HCl ------> MgCl2 + H2O
Na2O + 2HCl ------> 2NaCl + H2O
+ Nung kết tủa , dd NaCl và dd MgCl2
2AgCl --a/s----> 2Ag + Cl2
MgCl2 ----điện phân dung dịch----> Mg + Cl2
2NaCl ----điện phân nóng chảy---> 2Na + Cl2
+ Phần chất rắn thu đươc (Ag , Na và Mg) cho tác dụng với O2
2Ag + O2-----t*----> 2Ag2O
2Na + O2 --t*---> 2Na2O
2Mg + O2 --t*---> 2MgO
1) Tách MgO ra là : Magie và Oxi
Na2O: 2Natri và Oxi
Ag2O : 2Ag và Oxi
2) Tách hỗn hợp CuO: Đồng và Oxi
Al2O3 : 2Al và 3 Oxi
Mgo : Magie và Oxi
Không biết đúng hay không nha
Làm theo cảm tính

Cho t/d vs NaOh dư.
Al sẽ bị hòa tan hết còn lại Cu và Fe.
Cho hỗn hợp hai kim loại cn lại t/d vs HCl dư.
Cu ko p/ư thu đc Cu
Fe tạo FeCl2. Điên phân FeCl2 thu đc Fe
PTHH:
Fe +2HCl -> FeCl2 +H2
- Trích lấy mẫu thử cho vào ống nghiệm
- Cho các mẫu thử tác dụng với dd HCl lấy dư:
+ Thu được kim loại Cu không phản ứng
+ Dung dịch muối sắt (II) và muối nhôm
PTHH: Fe + 2HCl -> FeCl2 + H2
2Al + 6HCl -> 2AlCl3 + 3H2
- Cho dung dịch muối qua dd NaOH dư:
+ Tạo kết tủa không tan là Fe(OH)2
PTHH: FeCl2 + 2NaOH -> Fe(OH)2 + 2NaCl
+ Tạo kết tủa trắng tan dần trong dung dịch là Al(OH)3
PTHH: AlCl3 + 3NaOH -> Al(OH)3 + 3NaCl
Al(OH)3 + NaOH -> NaAlO2 + 2H2O
- Nung kết tủa thu được trong môi trường không có không khí, sau đó cho tác dụng với H2 dư, thu được kim loại Fe:
PTHH: Fe(OH)2 -t0-> FeO + H2O
FeO + H2 -> Fe + H2O
- Sục khí CO2 vào dung dịch còn lại, thu được kết tủa, nung kết tủa và điện phân nóng chảy, thu được Al
PTHH: NaAlO2 + 2H2O + CO2 -> Al(OH)3 + NaHCO3
2Al(OH)3 -t0-> Al2O3 + 3H2O
2Al2O3 -đpnc-> 4Al + 3O2

để khử hoàn 24g hỗn hợp Fe2O3 và CuO cần dùng vừa 8,96l H2(đktc) đun nóng
a)tính khối lượng mỗi oxit trong hỗn hợp đầu
b)% m kim loại tạo thành sau phản ứng
c)Trình bày phương pháp để tách Cu ra khỏi hỗn hợp
e gửi lại đề

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,1<-------------------------0,15
=> \(\%m_{Al}=\dfrac{0,1.27}{9,1}.100\%=29,67\%=>\%m_{Cu}=100\%-29,67\%=70,33\%\)

ta có Ax + By = 23.8 (1) ( dữ kiện : khối lượng hỗn hợp kim loại )
x+ 3y = 0.8 ( dữ kiện : cần 8.96 lít O2 )
và có dữ kiện cuối cùng là hỗn hợp chất rắn sau khi bị khử bởi H2 còn lại 33.4 gam
thì ta tính đọc số mol Oxi còn trong hỗn hợp là 0.6
TH1 chỉ có A bị khử thì số mol oxi trong hỗn hợp trên là của B  3y = 0.6
3y = 0.6  x = 0.2
x = 0.2
mà B hóa trị 3 và không bị khủ thì chỉ có thể là Al  A là Zn
A là Zn
TH2 chỉ có B bị khử ta tính được số mol trong hỗn hợp trên là của A  x =0.6 y = 0.2/3
x =0.6 y = 0.2/3
ta tính : ráp số vào phương trình (1) ta được 0.6A +0.4/3B =23.8
từ đó ta có 23.8 / 0.6 < A,B< 23.8*3/0.4
lúc này ta lục bảng tuần hoàn và thế vô đều không thỏa mãn nên th2 loại
vậy kim loại cần tìm là Zn và Al

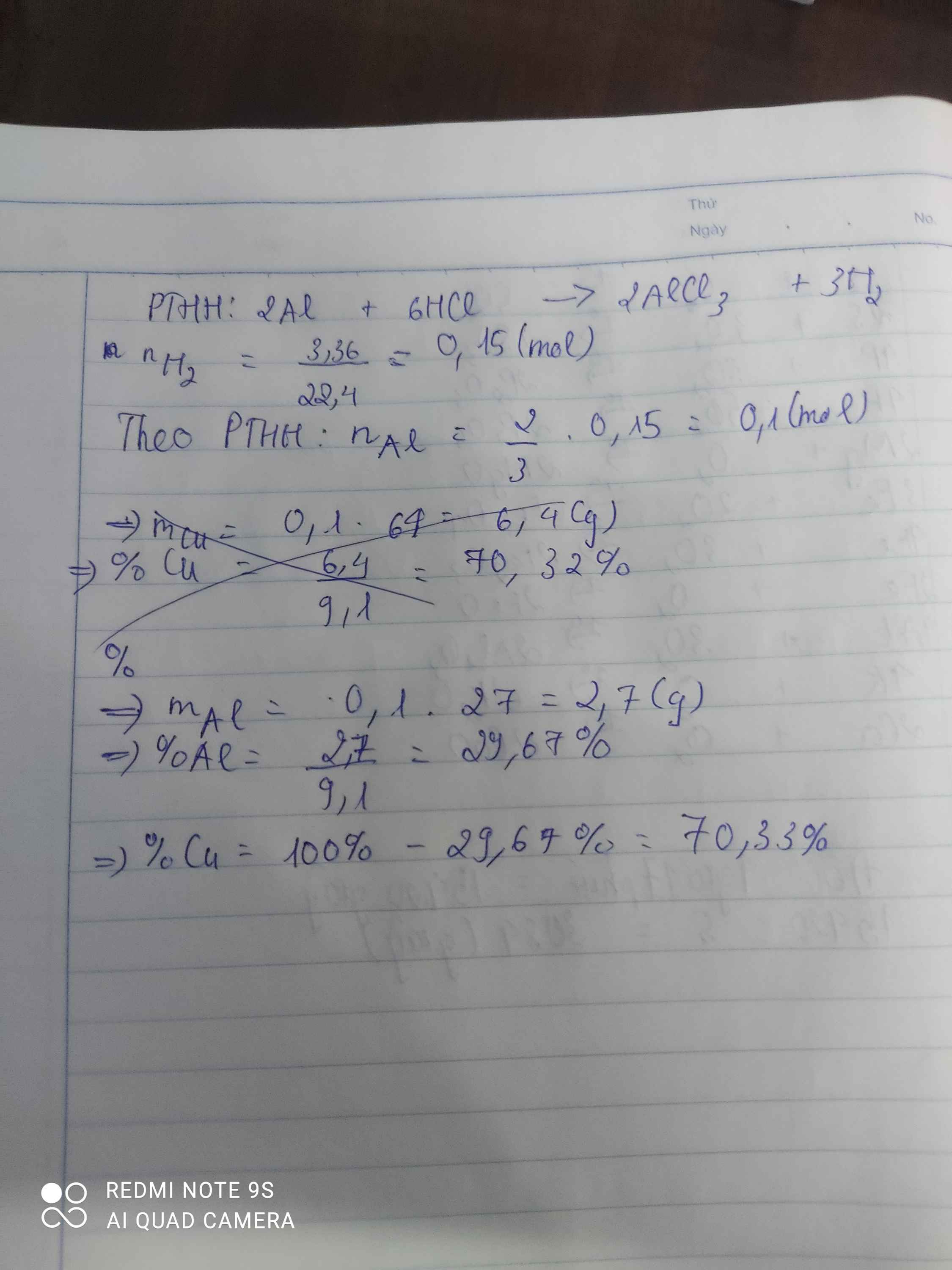

nhưng còn cái này thì ko tính :V
Thả hỗn hợp vào dung dịch HCl, Al tan tạo thành AlCl3, Cu không tan