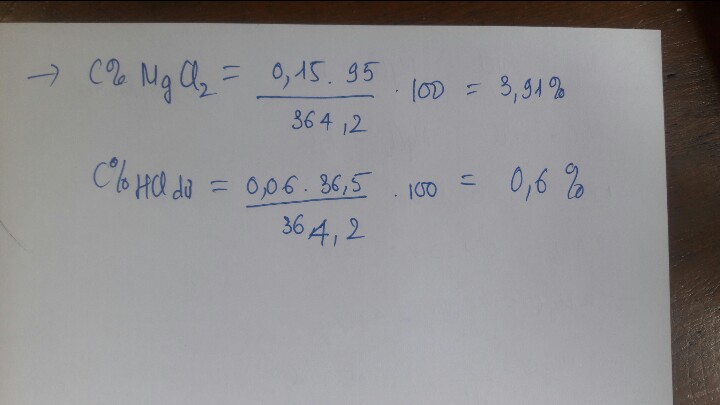Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khi cho hỗn hợp vào H2SO4 thì chỉ Zn phản ứng
\(n_{H_2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
______0,2<-------------------------------0,2______(mol)
=> \(m_{Zn}=0,2.65=13\left(g\right)\)
=> \(m_{Ag}=20-13=7\left(g\right)\)
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\frac{13}{20}.100\%=65\%\\\%m_{Ag}=\frac{7}{20}.100\%=35\%\end{matrix}\right.\)

nH2 PT (1) = \(\dfrac{3,36}{22,4}\)= 0,15 (mol)
2Al + 2NaOH + 2H2O ----> 2NaAlO2 + 3H2
0,1 0,15 (mol)
nH2 PT (2), (3) = \(\dfrac{7,84}{22,4}\)= 0,35 (mol)
2Al + 6HCl ----> 2AlCl3 + 3H2
0,1 0,15 (mol)
Mg + 2HCl ----. MgCl2 + H2
0,2 0,2 (mol)
=> mAl = 0,1.27 = 2,7 (g)
=> mMg = 0,2.24 = 4,8 (g)
%Al = \(\dfrac{2,7.100\%}{9}\)= 30%
%Mg = \(\dfrac{4,8.100\%}{9}\)= 53,3%
%Al2O3 = 100 - 30 - 53,3 = 16,7%

Ở thí nghiệm 2: Chỉ có Al tác dụng với dung dịch NaOH và bị hòa tan hết vì NaOH dư.
Chất rắn còn lại là Mg = 0,6 gam hay = 0,6 : 24 = 0,025 mol
Ở thí nghiệm 1: Số moi H2 = 1,568 : 22,4 = 0,07 mol. Gọi x là số mol Al.
Phương trình hóa học:
2Al + 3H2S04 \(\rightarrow\) Al2(S04)3 + 3H2
x \(\rightarrow\) 1,5x (mol)
Mg + H2S04 \(\rightarrow\) MgS04 + H2
0,025 \(\rightarrow\) 0,025 (mol)
Theo hiđro, ta có: 1,5x + 0,025 = 0,07 => x = 0,03 mol = mol Al Khối lượng của hỗn hợp: m = mMg + mAl = 0,6 + 0,03.27 = 1,41 gam
%Mg = \(\dfrac{0,6}{1,41}\) x 100% = 42,55%; %Al = 100% - 42,55% = 57,45%.
Ở thí nghiệm 2: Chỉ có Al tác dụng với dung dịch NaOH và bị hòa tan hết vì NaOH dư.
Chất rắn còn lại là Mg = 0,6 gam hay = 0,6 : 24 = 0,025 mol
Ở thí nghiệm 1: Số moi H2 = 1,568 : 22,4 = 0,07 mol. Gọi x là số mol Al.
Phương trình hóa học:
2Al + 3H2S04 → Al2(S04)3 + 3H2
x → 1,5x (mol)
Mg + H2S04 → MgS04 + H2
0,025 → 0,025 (mol)
Theo hiđro, ta có: 1,5x + 0,025 = 0,07 => x = 0,03 mol = mol Al Khối lượng của hỗn hợp: m = mMg + mAl = 0,6 + 0,03.27 = 1,41 gam
%Mg = x 100% = 42,55%; %Al = 100% - 42,55% = 57,45%.

nH2=0.56:22,4=0,025 mol
Fe+H2SO4----->FeSO4+H2
2AL+3H2SO4----->AL2(SO4)3 +3H2
Gọi x,y làn lượt là số mol Fe và AL
ta có hệ pt
\(\begin{cases}56x+27y=0,83\\x+1,5y=0,025\end{cases}\)
\(\begin{cases}x=0,01mol\\y=0,01mol\end{cases}\)
mFe=0,01.56=0,56 g
mAl=0,83-0,56=0,27 g
%mFe=(0,56:0,83).100=67,47%
%mAl=100-67,47=32,53%

\(n_{H_2}=0,9\left(mol\right)\\ Đặt:n_{Zn}=a\left(mol\right);n_{Mg}=b\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}65a+24b=40,65\\a+b=0,9\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,4646341463\\b=0,4353658537\end{matrix}\right.\)
Xem lại đề nha em

Gọi số mol của Al và Fe lần lượt là a và b
Ta có 1,5a + b = 0,25
1,5a = 0,15
=> a = 0,1 và b = 0,1
=> %Al = 32,53%
%Fe= 67,47%