Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

bạn ơi bạn thiếu nồng độ mol của etanol thì làm sao tính được số mol của nó ạ?

1. Phương trình hoá học của các phản ứng :
2 N H 3 + 3CuO → t ° N 2 + 3Cu + 3 H 2 O (1)
Chất rắn A thu được sau phản ứng gồm Cu và CuO còn dư. Chỉ có CuO phản ứng với dung dịch HCl :
CuO + 2HCl → C u C l 2 + H 2 O (2)
2. Số mol HCl phản ứng với CuO : n H C l = 0,02.1 = 0,02 (mol).
Theo (2), số mol CuO dư : n C u O = n H C l / 2 = 0,01 (mol).
Số mol CuO tham gia phản ứng (1) = số mol CuO ban đầu - số mol CuO dư = 0,03 (mol).
Theo (1) n N H 3 = 2 n C u O /3 = 0,02 (mol) và nN2 = n C u O /3 = 0,01 (mol).
Thể tích khí nitơ tạo thành : 0,01. 22,4 = 0,224 (lít) hay 224 ml.

1. nKOH = 30/1000*2 = 0,06 mol
nCH3COOH = nKOH = 0,06 mol (bạn tự viết PTHH)
=> CCH3COOH=\(\frac{0,06}{0,05}=1,2M\)
=> Trong 125ml axit có chứa 0,06*125/50 = 0,15 mol CH3COOH
BTNT ta có nCH3COOH = nCH3COONa = 0,15 mol
=> m muối = m CH3COONa = 12,3 gam.
2. nH2= 0,5 mol
Gọi nCH3OH = a, nC6H5OH = b (mol)
PTTQ 2CH3-OH + 2Na → 2CH3-ONa + H2
2C6H5-OH + 2Na → 2C6H5-ONa + H2
=> nROH = nCH3OH + nC6H5OH = 2nH2
=> a + b = 1 mol
nC6H2Br3OH = 0,18 mol = nC6H5OH = b => a = 1-0,18 = 0,82 mol
=> mC6H5OH = 0,18*94 = 16,92g
mCH3OH = 26,24 gam
=> %C6H5OH = \(\frac{16,92\cdot100\%}{16,92+26,24}\)= 39,2%
=> %CH3OH = 60,8%

$n_{Al(NO_3)_3} = n_{Al} = 0,11(mol)$
$\Rightarrow n_{NH_4NO_3} = \dfrac{25,83 - 0,11.213}{80} = 0,03(mol)$
Bảo toàn electron :$3n_{Al} = 8n_{NH_4NO_3} + 3n_{NO}$
$\Rightarrow n_{NO} = 0,03(mol)$
$V = 0,03.22,4 = 0,672(lít)$
$n_{HNO_3} = 10n_{NH_4NO_3} + 4n_{NO} = 0,42 \Rightarrow x = 0,42 : 2 = 0,21$
$C_{M_{Al(NO_3)_3}} = \dfrac{0,11}{0,21} = 0,52M$
$C_{M_{NH_4NO_3}} = \dfrac{0,03}{0,21} = 0,1428M$
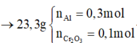
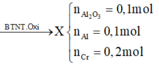
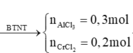
a, \(n_K=\dfrac{0,975}{39}=0,025\left(mol\right)\)
A là khí H2, B là CH3COOK
PTHH: 2K + 2CH3COOH → 2CH3COOK + H2
Mol: 0,025 0,025 0,0125
b, \(C_{M_{ddCH_3COOH}}=\dfrac{0,025}{0,1}=0,25M\)
c, \(V_{H_2}=0,0125.22,4=0,28\left(l\right)\)