Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho phản ứng : Zn + CuCl2 → ZnCl2 + Cu
Trong phản ứng này, 1 mol ion Cu2+:
A. đã nhận 1 mol electron. B. đã nhận 2 mol electron,
C. đã nhường 1 mol electron. D. đã nhường 2 mol electron.
Zn + CuCl2 → ZnCl2 + Cu
Trong phản ứng này, 1 mol ion Cu2+:
A. đã nhận 1 mol electron.
B. đã nhận 2 mol electron,
C. đã nhường 1 mol electron.
D. đã nhường 2 mol electron.
vì Cu trước phản ứng có số oxh là +2
Cu sau phản ứng có số oxh là 0
nên Cu đã nhận 2 mol electron để từ Cu+2 thành Cu0

a) Số oxi hóa của S trong các chất: H2, S-2 , S0, H2S+4O3, H2S+6O4
b) Số oxi hóa của Cl trong các hợp chất: HCl-1, HCl+1O, NaCl+3O2, HCl+5O3, HCl+7O4.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2Cl2, Mn+4O2, KMn+7O4
d) 

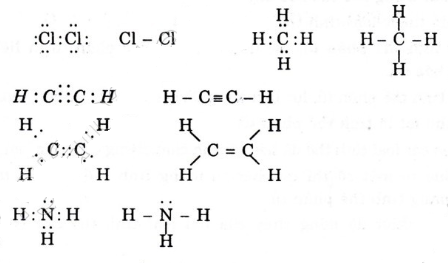
Công thức electron và công thức cấu tạo của các phân tử sau :

Nhường e: ( Fe2+ ----> Fe3+ + 1e ) *14
Nhận e: S+6 +2e ----> S+4 (Tỉ lệ 1:2)
2S+6 + 12e ----> 2S0
=> 3S+6 +14e -----> S+4 + 2S0
Cân bằng: 14FeO + 48H+ + 3SO42- →14Fe3+ + SO2 + 2S + 24H2O
.jpg)
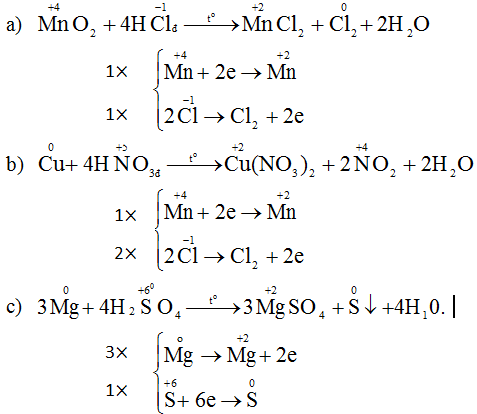
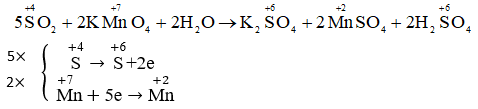
Chọn A. Vì trong phản ứng trên, Cu đóng vai trò là chất oxi hóa (nhận thêm e) và sau phản ứng, số oxi hóa của Cu giảm.
\(Cu^{+2}+2e\rightarrow Cu^0\)
1 (mol) ----> 2 (mol)