Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Áp dụng công thức
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ p 2 p 1 = T 2 V 1 V 2 . T 1 = 273 + 77 .4 1. 273 + 17 = 7 l ầ n

\(T_1=27^oC=300K\)
\(T_2=60^oC=333K\)
Quá trình khí lí tưởng:
\(\dfrac{p_1V_1}{T_1}=\dfrac{p_2V_2}{T_2}\)
\(\Rightarrow\dfrac{p_1\cdot10}{300}=\dfrac{p_2\cdot4}{333}\)
\(\Rightarrow p_1=\dfrac{40}{111}p_2\)
\(\Rightarrow p_2=2,775p_1\)

Đáp án C
Từ phương trình trạng thái:
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ p 2 p 1 = v 1 v 2 . T 2 T 1
Thay số: p 1 p 2 = 24 8 . 273 + 77 273 + 27 = 3 , 5 lần

1/ Quá trình biến đổi trạng thái khi thể tích không đổi gọi là đẳng tích
Định luật: Trong quá trình đẳng tích của một lượng khí nhất định, áp suất tỉ lệ thuận với nhiệt độ tuyệt đối
Biểu thức:
\(\frac{P}{T}=\) hằng số
+Lưu ý: Nếu gọi \(P_1,T_1\) là áp suất và nhiệt độ tuyệt đối của 1 lượng khí ở trạng thái 1
Nếu gọi \(P_2,T_2\) là áp suất và nhiệt độ tuyệt đối của 1 lượng khí ở trạng thái 2
Ta có biểu thức: \(\frac{P_1}{T_1}=\frac{P_2}{T_2}\)
2/ Phương trình trạng thái khí lí tưởng:
\(\frac{p_1V_1}{T_1}=\frac{p_2V_2}{T_2}\)
Tính ra \(p_2=2,58atm\)

Chọn tráng thái 1 là trạng thái đầu chưa nén.
\(t_1=47^0\Rightarrow T_1=47+273=320K.\)
\(V_1=1,8l.\)
\(P_1=100kPa.\)
Trạn thái 2 là trạng thái cuối cùng sau 4 chu kì.
\(t_2=367^0\Rightarrow T_2=367+273=640K.\)
\(V_2=0,3l.\)
\(P_2\)
Áp dụng phương trình trạng thái cho khí lí tưởng ta có
\(\frac{P_1V_1}{T_1}=\frac{P_2V_2}{T_2}\)
=> \(P_2=\frac{P_1V_1.T_2}{V_2T_1}=\frac{100.1,8.640}{0.3.320}=1200kPa.\)
Độ tăng áp suất là \(\Delta V=V_2-V_1=1200-100=1100kPa=1,1.10^6Pa.\)

Gọi \(m_1;m_2\) là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: \(pV=\frac{m_1}{\mu}RT_1;pV=\frac{m_2}{\mu}RT_2\)
Từ đó suy ra khối lượng khí đã thoát ra:
\(m_2-m_1=\frac{pV\mu}{R}\left(\frac{1}{T_1}-\frac{1}{T_2}\right)\), với \(p=50atm,V=10\)lít \(,\mu=2g\)
\(R=0,084atm.l\text{/}mol.K;\)\(T_1=7+273=280K\)
\(T_2=17+273=290K\). Suy ra \(m_2-m_1=1,47g\)
Gọi m1,m2m1,m2 là khối lượng khí trong bình trước và sau khi đun nóng bình. Áp dụng phương trình Menđêlêep - Clapêrông ta có: pV=m1μRT1,pV=m2μRT2pV=m1μRT1,pV=m2μRT2
Từ đó suy ra khối lượng khí đã thoát ra:
m2−m1=pVμR(1T1−1T2)m2−m1=pVμR(1T1−1T2), với p=50atm,V=10lít,μ=2gp=50atm,V=10lít,μ=2g
R=0,084atm.l/mol.K;T1=7+273=280KR=0,084atm.l/mol.K;T1=7+273=280K
T2=17+273=290KT2=17+273=290K. Suy ra m2−m1=1,47g

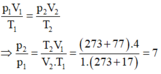
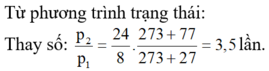
Áp dụng công thức
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ p 2 p 1 = T 2 V 1 V 2 . T 1 = ( 273 + 60 ) .10 4. ( 273 + 27 ) = 2 , 775