
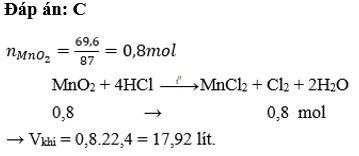
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

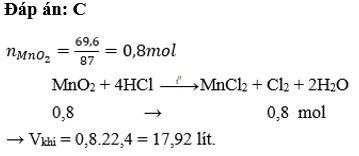

Hỗn hợp A gồm 0,56 g Fe và 16 g Fe2O3.Trộn A với m gam bột nhôm rồi nungở nhiệt độ cao (không có không khí), thu được hỗn hợp D. Nếu cho D tan trong dung dịch H2SO4loãng dư thì thu được a lít khí, nhưng cho D tác dụng với dung dịch NaOH (dư) thì thể tích khí thu được là 0,25a lít (trong cùng điều kiện). Khoảng giá trị của m là
A. 0,54 < m < 2,70. B. 2,7 < m < 5,4.
C. 0,06 < m < 6,66. D. 0,06 < m < 5,4.
nFe = 0.01
nFe2O3 = 0.1
Gọi hiệu suất pứ nhiệt nhôm là h ( 0 < h < 1 )
h = 0
=> Al chưa pứ
nH2 do Fe sinh ra = (a - 0.25a)/22.4 = 0.01
=> a = 112/375
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => m = 0.06
h =1 :
Al dư,Fe2O3 hết
nAl pứ = 2nFe2O3 = 0.2
=> nFe = 0.1*2 + 0.01 = 0.21
nH2 do fe sinh ra = (a - 0.25a)/22.4 = 0.21
=> a = 6.272
nH2 do Al sinh ra = 0.25a/22.4
=> nAl = 5a/672 => nAl ban dầu = 5a/672 + 0.2 = 0.74/3
=> m = 6.66g
=> C 0,06 < m < 6,66

(đốt trong oxi dư => các Kl đều lên số
oxh cao nhất)
ta có: mO=m oxit - m kl =46,4-40=6,4g
=> nO =6.4/16=0,4 mol
bạn để ý O trong oxit khi t/d vs HCl sẽ đi
hết vào trong H2O
=>nH2O=nO=0,4 mol
=> nHCl = 2nH2O=0,8 mol
=> VHCl=0,8/2=0,4(l)=400 ml
=>đáp án A

2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2 + 6H2O
\(n_{SO_2}=\dfrac{3}{2}n_{Fe}=0,15\left(mol\right)\)
=> VSO2=0,15.22,4=3,36(lit)
=> Chọn C
Số mol của sắt
nFe = \(\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
Pt : Fe + 2H2SO4 → FeSO4 + SO2 + 2H2O\(|\)
1 2 1 1 2
0,1 0,1
Số mol của khí lưu huỳnh đioxit
nSO2 = \(\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
Thể tích của khí lưu huỳnh ddioxxit ở dktc
VSO2 = nSO2 . 22,4
= 0,1. 22,4
= 2,24 (l)
⇒ Chọn câu : A
Chúc bạn học tốt

nFe=nH2=0,1 Mol
-> nFeO =0,1 Mol
tổng Fe=0,2 mol
Bảo toàn Fe có nFe2O3=1/2nFe=0,1 mol
mFe2O3= 16 gam

Phần 2: do tác dụng với NaOH dư sinh ra H2 => Al dư
n H2 = 0,84 / 22,4 = 0,0375
Al + NaOH + H2O = NaAlO2 + 3/2 H2
0,025....................................
=> n Al dư = 0,025
Phần 1: n H2 = 3,08 / 22,4 = 0,1375
Al + 3H2SO4 = Al2(SO4)3 + 3H2
0,025_________________0,075
Fe + H2SO4 = FeSO4 + H2
0,0625..........................0,0625
* n Al2O3 = n Fe = 0,0625 => n Al phản ứng = 0,125
=> n Al = 0,125 + 0,025 = 0,15 => m Al = 4,05 (g)
* n Fe2O3 = n Fe/2 = 0,03125 => m Fe2O3 = 5 (g)
=> m hh = 2(m Fe + m Al) = 2(5 + 4,05) = 18,1 (g)
\(2Al+Fe_2O_3\rightarrow2Fe+Al_2O_3\)
Vậy chất rắn Y là \(Al_2O_3\) ;Fe và Al dư
Phần 1 \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\) (1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\) (2)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\) (3)
\(n_{H_2}=0,1375\left(mol\right)\)
Phần 2 \(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\) (4)
\(2Al+2H_2O+2NaOH\rightarrow2NaAlO_2+H_2\uparrow\) (5)
\(n_{H_2}=\dfrac{0,84}{22,4}=0,0375\left(mol\right)\)
Theo (5) \(n_{Al}=0,025\left(mol\right)\)
Theo (2) và (1) \(n_{H_2}=0,1\left(mol\right)\Rightarrow n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\)\(\sum n_{Fe}=0,1\left(mol\right)\rightarrow m_{Fe_2O_3}=0,1\times160=16\left(g\right)\)
\(\sum n_{Al}=\left(0,2+0,05\right)\times27=6,75\left(g\right)\)
Vậy \(m=16+6,75=22,75\left(g\right)\)

Khi cho A vào H2O và khi cho A vào NaOH thể tích khí thoát ra khác ở TN1 bé hơn chứng tỏ trong TN1 Al dư, vậy nH2 = 0,04 mol = 4nBa => nBa = 0,01 mol
Ba + H2O ------> Ba(OH)2 + H2
Al + OH- + H2O -----> AlO2- + 3/2 H2
nOH- = 2nBa
nH2 = nBa + 3/2.2nBa = 4nBa
nH2 ở TN2 = 0,31 mol = nBa + 3/2 nAl ( Vì OH- dư)
=> nAl = 0,2 mol
nH2 ở TN3 = 0,41 mol = nBa + 3/2nAl + nMg
=> nMg = 0,1 mol
Al + 3HCl -----> AlCl3 + 3/2H2
Mg + HCl -------> MgCl2 + H2
1. m = 21,5 gam
%Ba = 0,1.137/ 21,5.100 = 63,72%
%Al = 0,2.27/ 21,5.100 = 25,12%
%Mg = 100 -25,12 - 63,62 = 11,16%

Chỉ có Al td vs HCl →H2 suy ra mol Al=0,1mol
sau đó Al bị thụ động trong HNO3đặc,nguội nên chỉ có Cu td vs Hno3 →NO2 bảo toàn e suy ra mol Cu=0,15mol.
mg=mal+mcu=12,3g