Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

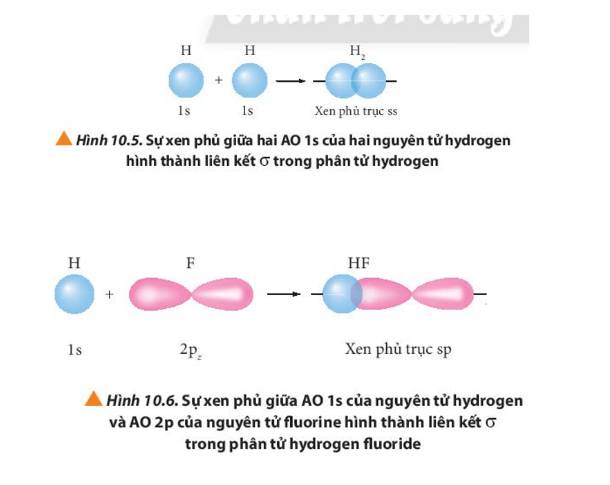
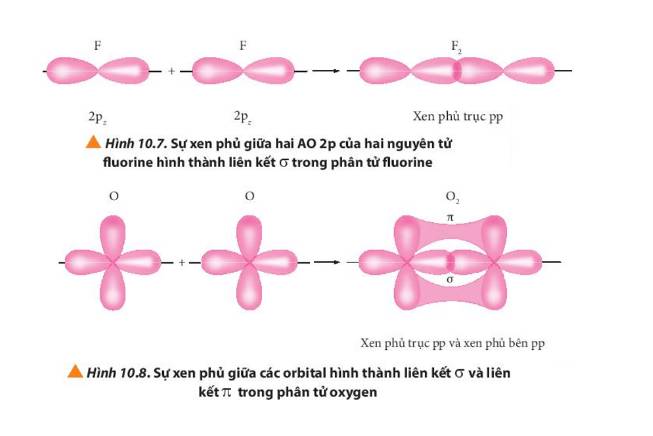
- Liên kết σ trong mỗi phân tử được tạo thành bởi sự xen phủ trục
- Liên kết п trong mỗi phân tử được tạo thành bởi sự xen phủ bên

- Nguyên tử X có 16 proton => Nguyên tử S
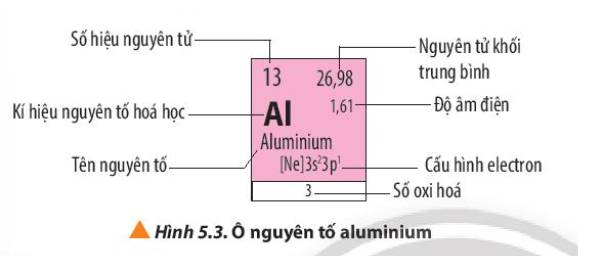
- Số proton = số hiệu nguyên tử = 16 => Z = 16
- Số khối = số proton + số neutron = 16 + 16 = 32
=> Kí hiệu nguyên tử X: \({}_{16}^{32}S\)
Đáp án C

- Trong mỗi chu kì, theo chiều từ trái sang phải bán kính nguyên tử có xu hướng giảm dần.
- Trong mỗi nhóm, theo chiều từ trên xuống dưới, bán kính nguyên tử có xu hướng tăng dần.

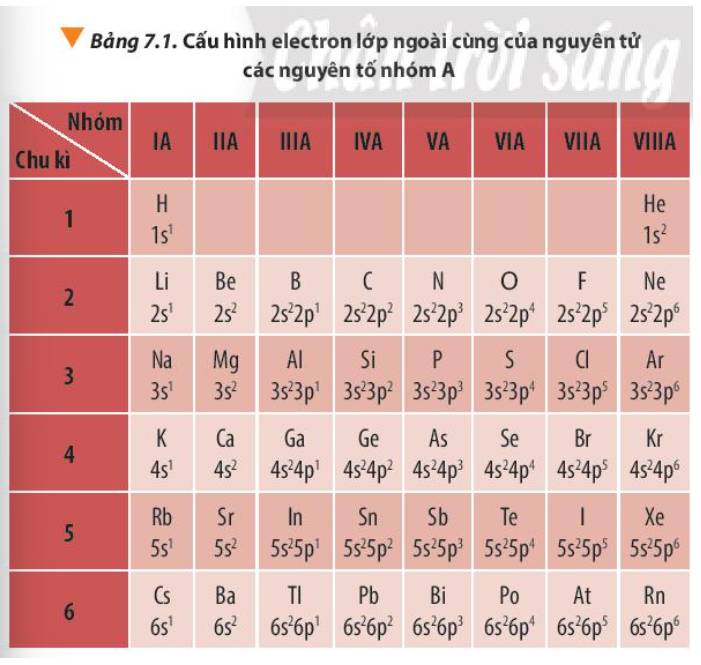
- Số electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm `A` trong cùng `1` chu kì có xu hướng tăng dần từ trái qua phải và `2` nguyên tố cạnh nhau hơn kém `1 e.`
- Số electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm `A` trong cùng `1` nhóm thì có số electron lớp ngoài cùng bằng nhau.

i:
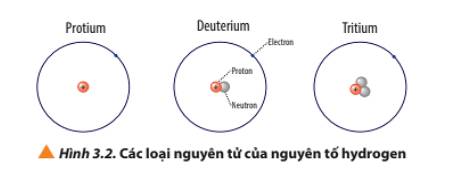
| Protium | Deuterium | Tritium |
Giống nhau | Đều có 1 electron và 1 proton | ||
Khác nhau | Không có neutron | 1 neutron | 2 neutron |

a)
- Nguyên tử protium: 1 proton, 0 neutron ⇒ Z = 1, A = 1
⇒ Kí hiệu: \(^1_1H\)
- Nguyên tử deuterium: 1 proton, 1 neutron ⇒ Z = 1, A = 2
⇒ Kí hiệu: \(^2_1H\)
- Nguyên tử tritium: 1 proton, 2 neutron ⇒ Z = 1, A = 3
⇒ Kí hiệu: \(^3_1H\)
b)
- Nguyên tử oxygen có 8 electron
⇒ Số E = Số P = Z = 8
- Nguyên tử oxygen có 8 neutron
⇒ Số khối A = P + N = 8 + 8 = 16
⇒ Kí hiệu nguyên tử: \(^{16}_8O\)

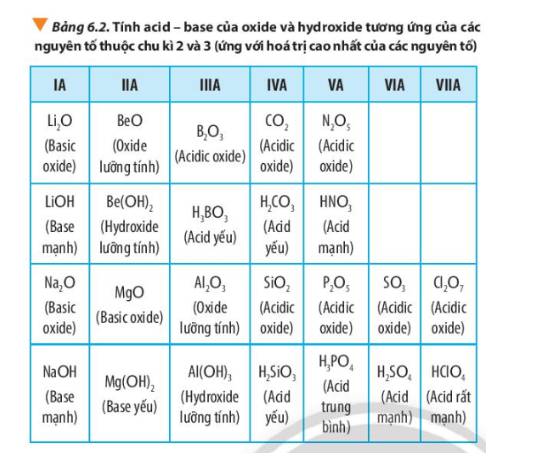
- Trong 1 chu kì:
+ Tính kim loại giảm dần, tính phi kim tăng dần.
+ Tính base của oxide, hydroxide giảm dần; tính acid của oxide, hydroxide tăng dần

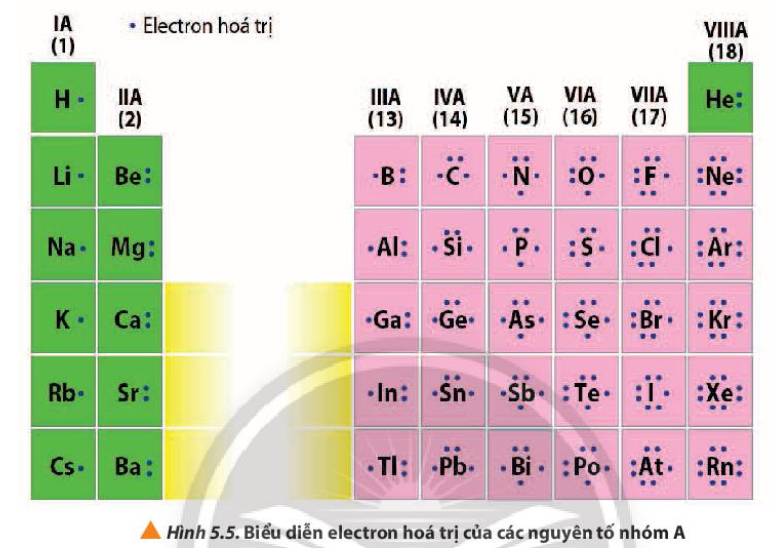
- Số electron hóa trị của nguyên tử = số thứ tự nhóm của nguyên tố nhóm A
Ví dụ:
+ Nhóm IA, các nguyên tố đều có 1 electron hóa trị
+ Nhóm IIIA, các nguyên tố đều có 3 electron hóa trị
+ Nhóm VIIIA (trừ He) các nguyên tố đều có 8 electron hóa trị
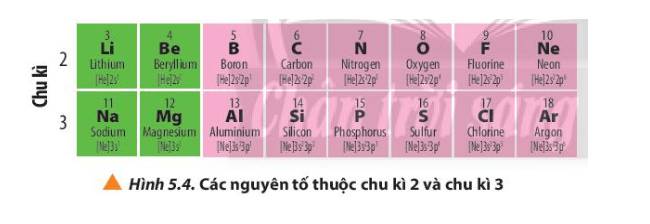
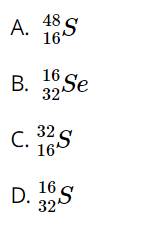


Số lớp eletron trong nguyên tử của các nguyên tố cùng chu kì đều bằng nhau.