Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi n là hóa trị của kim loại R
Ta có :
\(n_{SO_2} = \dfrac{10,08}{22,4} = 0,45(mol)\\ \)
Bảo toàn electron :
\(nn_R = 2n_{SO_2} \Rightarrow n_R = \dfrac{0,9}{n}(mol)\\ \Rightarrow \dfrac{0,9}{n}.R = 8,1\\ \Rightarrow R = 9n\)
Với n = 3 thì R = 27(Al)
Vậy kim loại R là Al
n SO2=10,08/22,4=0,45mol
TH1 R có hóa trị 1
2R + 2H2SO4 đ--> R2SO4 + SO2 + 2H2O
0,9 0,45 mol
=> M R=8,1/0,9=9=>R là Be loai vì Be hóa trị 2
TH2 nếu R có hóa trị 2
R + 2H2SO4 --> RSO4 + SO2 +2H2O
0,45 0,45 mol
=> M R =8,1/0,45=18=> là Ar loại vì Ar là khí hiếm
TH3 nếu r có hóa trị 3
2R + 6H2SO4--> R2(SO4)3 + 3SO2 + 6H2O
0,3 0,45 mol
=> M R =8,1/0,3=27 => R là Al chọn
vậy R là Al

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.

M + 2H2SO4 => MSO4 + SO2 + 2H20
nSO2 = 1.68/22.4 = 0.075 MOL
=> nKIM LOẠI M = 0.075 mol
M của Kl M = m/n = 4.8/0.075 = 64 => Cu

a) Gọi nCu = a (mol) => nFe = a (mol)
=> 64a + 56a = 12
=> a = 0,1 (mol)
PTHH:
Cu + 2H2SO4 (đặc, nóng) ---> CuSO4 + SO2 + 2H2O
0,1------------------------------------------->0,1
2Fe + 6H2SO4 (đặc, nóng) ---> Fe2(SO4)3 + 3SO2 + 6H2O
0,1--------------------------------------------------->0,3
=> VSO2 = (0,3 + 0,1).22,4 = 8,96 (l)
b) \(n_{hh}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(M_{hh}=24,5.2=49\left(\dfrac{g}{mol}\right)\)
Áp dụng sơ đồ đường chéo, ta có:
\(\dfrac{n_{SO_2}}{n_{H_2S}}=\dfrac{V_{SO_2}}{V_{H_2S}}=\dfrac{64-49}{49-34}=\dfrac{1}{1}\)
\(\rightarrow n_{SO_2}=n_{H_2S}=\dfrac{0,1}{2}=0,05\left(mol\right)\)
PTHH:
2R + 2nH2SO4 (đặc, nóng) ---> R2(SO4)n + nSO2 + 2nH2O
\(\dfrac{0,1}{n}\)<------------------------------------------------0,05
8R + 5nH2SO4 (đặc, nóng) ---> 4R2(SO4)n + nH2S + 4nH2O
\(\dfrac{0,4}{n}\)<-------------------------------------------------0,05
\(\rightarrow n_R=\dfrac{0,1}{n}+\dfrac{0,4}{n}=\dfrac{0,5}{n}\left(mol\right)\\ \rightarrow M_R=\dfrac{4,5}{\dfrac{0,5}{n}}=9n\left(\dfrac{g}{mol}\right)\)
Xét n = 3 thoả mãn => MR = 27 (g/mol)
Vậy R là Al

Đáp án C
Số mol SO2 thu được là: n SO 2 = 0 , 2 mol
Gọi hóa trị của M là n
Số mol của M là : n M = 12 , 8 M mol
Sơ đồ phản ứng :
![]()
Các quá trình nhường, nhận electron :


Ta có: \(n_{SO4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ M_M=\dfrac{18}{0,2}=65\)
Vậy kim loại cần tìm là Zn

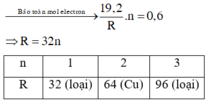
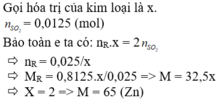
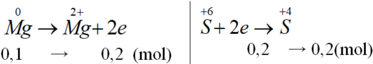
Gọi hóa trị của R là x
2R + 2xH2SO4 đ,n => R2(SO4)x + xSO2 + 2xH2O
nSO2 = V/22.4 = 6.72/22.4 = 0.3 (mol)
Theo phương trình ==> nR = 0.3x2/x = 0.6/x (mol)
R = m/n = 12.8/(0.6/x) = 64/3x
Ko biết đề có nhầm số k nhỉ hmm