Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Áp suất ban đầu là \(p_1\left(atm\right)\)
Áp suất lúc sau: \(p_2=\dfrac{1}{2}p_1\left(atm\right)\)
Áp dụng quá trình đẳng tích: \(\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\)
\(\Rightarrow\dfrac{p_1}{3+273}=\dfrac{\dfrac{1}{2}p_1}{T_2}\)
\(\Rightarrow\dfrac{1}{3+273}=\dfrac{1}{2}\cdot\dfrac{1}{T_2}\)
\(\Rightarrow T_2=138K\)
Áp suất ban đầu là p1(atm)p1(atm)
Áp suất lúc sau: p2=12p1(atm)p2=12p1(atm)
Áp dụng quá trình đẳng tích: p1T1=p2T2p1T1=p2T2
⇒p13+273=12p1T2⇒p13+273=12p1T2
⇒13+273=12⋅1T2⇒13+273=12⋅1T2
⇒T2=138K

Xét lượng khí còn lại trong bình
Trạng thái 1: V 1 = V/2; T 1 = 27 + 273 = 300 K; p 1 = 40 atm.
Trạng thái 2: V 2 = V; T 2 = 12 + 273 = 285 K; p 2 = ? atm,
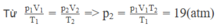

Xét lượng khí trong bình.
Trạng thái đầu: V 1 = 8 lít; T 1 = 100 + 273 = 373 K ; p 1 = 10 5 N/ m 2
Trạng thái cuối: V 2 = 8 lít; T 2 = 20 + 273 = 293 K; p 2 = ?
Vì thể tích không đổi nên:
p 1 / T 1 = p 2 / T 2 ⇒ p 2 = p 1 T 2 / T 1 = 7,86. 10 4 N/ m 2

Khi khí chưa thoát ra ngoài ta có: p 1 V 1 = m 1 μ R T 1 (1)
Khi một nửa lượng khí đã thoát ra ngoài ta có:
p 2 V 2 = m 2 μ R T 2 với V1 và m 2 = m 1 2 ⇒ p 2 V 1 = m 1 2 μ R T 2
Từ (1) và (2) ⇒ p 2 = p 1 T 2 2 T 1 = 40.285 2.300 = 19 a t m

Cần tác dụng vào nắp một lực thằng được trọng lượng của nắp và lực gây ra bởi sự chênh lệch áp suất giữa không khí bên ngoài và bên trong bình:
F = mg + S( p 1 - p 2 ) = mg + π d 2 /4( p 1 - p 2 ) = 692N

\(a,\dfrac{p_1}{T_1}=\dfrac{p_2}{T_2}\Rightarrow T_2=\dfrac{T_1p_2}{p_1}=\dfrac{303.4.10^5}{2.10^5}=606^oK\\ b,T_2=\dfrac{303.10^5}{2.10^5}=151,5^oK\)

+ Khi khí chưa thoát ra ngoài ta có:
![]()
+ Khi một nửa lượng khí đã thoát ra ngoài ta có:
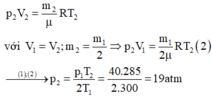

Ta có : T1 = toC + 273 = 30 + 273 = 303oK
p1 = 2 bar = 2 . 105 Pa
p2 = 4 bar = 4 . 105
Vì quá trình là đẳng tích , áp dụng định luật Charles ta có
\(\frac{p_1}{p_2}=\frac{T_1}{T_2}\)→ T2 = \(\frac{p_2.T_1}{p_1}=\frac{4.10^5.303}{2.10^5}\)= 606oK
Vậy để áp suất tăng lên gấp đôi , ta phải tăng nhiệt độ lên 606oK
* Trạng thái 1: T1 = 273 + 30 = 303 K
p1 = 2 bar
* Trạng thái 2: T2 = ? p2 = 2p1
* Vì thể tích bình không đổi nên:
\(\frac{P1}{T1}=\frac{P2}{T2}\Rightarrow T2=\frac{P2.T1}{P1}=\frac{2P1.T1}{P1}\) = 2T1 = 606 K

Trạng thái 1: T1 = t1 + 273 = 303 K; P1 = 2 bar
Trạng thái 2: P2 = 4 bar ; T2 = ?
Áp dụng định luật Sác-lơ cho quá trình biến đổi đẳng tích, ta có:
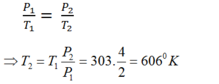
Tham khảo :)
Trạng thái 1: T1 = t1 + 273 = 303 K; P1 = 2 bar
Trạng thái 2: P2 = 4 bar ; T2 = ?
Áp dụng định luật Sác-lơ cho quá trình biến đổi đẳng tích, ta có: