Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phản ứng hóa hợp từ 2 hay nhiều chất tạo ra 1 chất
VD: \(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
Phản ứng phân hủy từ 1 chất tạo ra 2 hay nhiều chất
VD: \(CaCO_3\underrightarrow{t^o}CaO+CO_2\)
- Phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới (sản phẩm) được tạo thành từ 2 hay nhiều chất ban đầu
VD : \(4P+5O_2\left(t^o\right)->2P_2O_5\) (từ 2 chất tham gia PƯ chỉ tạo ra duy nhất 1 sản phẩm)
- Phản ứng phân hủy là một phản ứng hóa học mà trong đó một chất tham gia có thể tạo thành hai hay nhiều chất mới.
VD : \(CaCO_3\left(t^o\right)->CaO+CO_2\) ()từ 1 chất tham gia PƯ tạo thành 2 chất sản phẩm )

Phản ứng có dư là phản ứng mà ta tính ra đc 2 hoặc nhiều hơn số mol của phản ứng
Phản ứng thường là phản ứng chỉ tính đc 1 số mol

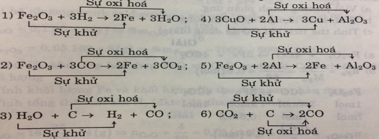
Các phản ứng trên đều là phản ứng oxi hóa khử vì xảy ra đồng thời sự khử và sự oxi hóa.
- Các chất khử: H 2 ; CO; C; Al; C
- Các chất oxi hóa: F e 2 O 3 ; H 2 O ; CuO; F e 2 O 3 ; C O 2

sự oxi hóa là phản ứng giữa Oxi với 1 chất
phản ứng hóa hợp là phản ứng chỉ có 1 chất mới được tạo thành từ 2 hay nhiều chất ban đầu
VD : S+O2 -to-> SO2
phản ứng phân hủy là phản ứng chỉ có 1 chất ban đầu tạo thành 2 hoặc nhiều chất sản phẩm
VD : 2KMnO4 -to-> K2MnO4 + MnO2 +O2
phản ứng thế là phản ứng 2 giữa đơn chất và hợp chất , nguyên tử của đơn chất sẽ thay thế nguyên tử 1 nguyên tố khác trong hợp chất
VD : Zn + 2HCl -> ZnCl2 + H2

a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Tỉ lệ: nAl : nO2 = 4:3
b, Phần này bạn xem lại đề nhé!

\(2Cu+O_2\underrightarrow{t^o}2CuO\\
4Al+3O_2\underrightarrow{t^o}2Al_2O_3\\
C_2H_4+4O_2\underrightarrow{t^o}2CO_2+4H_2O\\
2CO+O_2\underrightarrow{t^o}2CO_2\\
3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\
2Mg+O_2\underrightarrow{t^o}2MgO
\\
S+O_2\underrightarrow{t^O}SO_2\)
B)
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\\
Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\
2H_2+O_2\underrightarrow{t^o}2H_2O\\
HgO+H_2\underrightarrow{t^o}Hg+H_2O\\
PbO+H_2\underrightarrow{t^o}Pb+H_2O\)
Bài 1:
a, \(Cu+\dfrac{1}{2}O_2\underrightarrow{t^o}CuO\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(CO+\dfrac{1}{2}O_2\underrightarrow{t^o}CO_2\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(Mg+\dfrac{1}{2}O_2\underrightarrow{t^o}MgO\)
\(S+O_2\underrightarrow{t^o}SO_2\)
b, \(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(O_2+2H_2\underrightarrow{t^o}2H_2O\)
\(HgO+H_2\underrightarrow{t^o}Hg+H_2O\)
\(PbO+H_2\underrightarrow{t^o}Pb+H_2O\)
Bạn tự chỉ ra loại pư nhé!

..mk ghi lại y nguyên từ đề cô đưa mk nha..
( chứ mk ngồi nghĩ bài này cả buổi chiều ko ra nên lên đây)_

\(n_{Mg}=\dfrac{6}{24}=0,25\left(mol\right)\)
\(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PT: 2Mg + O2 ➝ 2MgO
Trước 0,25 0,1 0
Trong 0,2 0,1 0,2
Sau 0,05 0 0,2
nMgO = 0,2.40 = 8 (g)
PTHH : \(2Mg+O_2\rightarrow2MGgO\)
\(n_{Mg}=\dfrac{m}{M}=\dfrac{6}{24}=0,25\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT ta có : 2mol..........2mol
=> 0,25mol ...................x
=> \(n_{MgO}=x=\dfrac{0,25.2}{2}=0,25\left(mol\right)\)

PTHH: 3Fe + 2O2 =(nhiệt)=> Fe3O4
a) nFe = 5,6 / 56 = 0,1 (mol)
\(\Rightarrow n_{O2}=\frac{0,1.2}{3}=\frac{1}{15}\left(mol\right)\)
Thể tích oxi cần dùng ở điều kiện tiêu chuẩn là:
=> VO2(đktc) = \(\frac{1}{15}.22,4\approx1,5\left(lit\right)\)
b) nFe3O4 = \(\frac{0,1}{3}=\frac{1}{30}\left(mol\right)\)
=> mFe3O4 = \(\frac{1}{30}.232\approx7,73\left(gam\right)\)
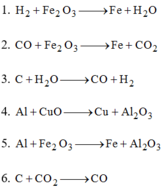
Có oxi :)
chậm mak