Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

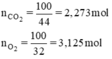
Thể tích của hỗn hợp khí ở 20°C và 1atm
Vhh = 24.(nO2 + nCO2) = 24.(3,125 + 2,273) = 129,552 l.

Biết \(m_{\text{O2}}=100g\Rightarrow M_{\text{O2}}=32\frac{g}{mol}\)
Và : \(m_{C\text{O2}}=100g\Rightarrow M_{C\text{O2}}=44\frac{g}{mol}\)
\(n_{\text{O2}}=\frac{m_{\text{O2}}}{M_{\text{O2}}}=\frac{100}{32}=3,125\left(mol\right)\)
\(n_{C\text{O2}}=\frac{m_{C\text{O2}}}{M_{C\text{O2}}}=\frac{100}{44}=2,273\left(mol\right)\)
\(\Rightarrow V=24\left(3,125+2,273\right)=129,552\left(l\right)\)

a) PTHH: C + O2 =(nhiệt)=> CO2
nC = 3,6 / 12 = 0,3 mol
=> nO2 = nC = 0,3 mol
=> VO2(đktc) = 0,3 x 22,4 = 6,72 lít
b) dCO2/KK = \(\frac{M_{CO2}}{29}=\frac{44}{29}\approx1,517>1\)
=> Khí CO2 nặng hơn không khí 1,517 lần
c) PTHH: S + O2 =(nhiệt)=> SO2
=> nS = nO2 = 0,3 mol
=> mS = 0,3 x 32 = 9,6 gam

nO2 = 100/32 = 3,125ml;
nCO2 = 100/44 = 2,273ml;
Vhh khí ở 20oC và 1atm là: 24.(3,125 + 2,273) = 129,552l.

Câu 1:
PTHH: S + O2 ==to==> SO2
a/ nS = 3,2 / 32 = 0,1 mol
nSO2 = nS = 0,1 (mol)
=> VSO2(đktc) = 0,1 x 22,4 = 2,24 lít
b/ nO2 = nS = 0,1 mol
=> VO2(đktc) = 0,1 x 22,4 = 2,24 lít
Mà không khí gấp 5 lần thể tích oxi
=> Thể tích không khí cần dùng là: 2,24 . 5 = 11,2 (lít)
Câu 3: Ta có \(\frac{d_A}{H_2}\)= 8
=> MA = MH2 . 8 = 2 . 8 = 16 g
mH = \(\frac{25\%.16}{100\%}\)= 4 g
mC = \(\frac{75\%.16}{100\%}\)= 12 g
nH = 4 mol
nC = 1 mol
CTHH : CH4

 Giúp mình bài này đi, mình đăng k ai trả lời hết!
Giúp mình bài này đi, mình đăng k ai trả lời hết!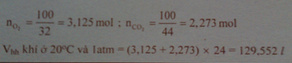
Ta có :
\(n_{O_2} = \dfrac{3,2}{32} = 0,1(mol)\\ n_{CO_2} = \dfrac{4,4}{44} = 0,1(mol\\\)
Suy ra :
\(n_{hỗn\ hợp\ khí} = 0,1 + 0,1 = 0,2(mol)\\ \Rightarrow V_{hh\ khí} = 0,2.22,4 = 4,48(lít)\)
Ta có: nCO2=\(\dfrac{4,4}{44}\)=0,1 mol
nO2=\(\dfrac{3,2}{32}\)=0,1 mol
Vậy: Vhỗn hợp=24x(0,1+0,1)=4,8 l