Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH:
2KNO3 \(\rightarrow\) 2KNO2 + O2
1/ Số mol của 2,4 g O2 là:
2,4 : 32 = 0,075 (mol)
Theo PTHH, số mol KNO3 cần dùng là 0,075 . 2 = 0,15 (mol)
Khối lượng KNO3 cần dùng là:
0,15 (39+14+16.3) = 15,15 (g)
Vì hiệu suất phản ứng là 8,5% nên khối lượng KNO3 thực cần dùng là:
15,15 : (100-8.5) . 100 = 16,56(g)
2/ Khối lượng KNO3 phân húy là:
10,1 : (39+14+16.3) = 0,1 (mol)
Theo PTHH, số mol O2 thu được là: 0,1 : 2 = 0,05 (mol)
Khối lượng khí O2 thu được là:
0,05 . 32 = 1,6 (g)

a) \(2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
Phản ứng phân hủy
b) \(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)
PTHH: 2KNO3 --to--> 2KNO2 + O2
0,15<--------------------0,075
=> \(m_{KNO_3\left(PTHH\right)}=0,15.101=15,15\left(g\right)\)
=> mKNO3 (thực tế) = \(\dfrac{15,15.100}{85}=17,824\left(g\right)\)
c) \(n_{KNO_3\left(pư\right)}=\dfrac{10,1.80\%}{101}=0,08\left(mol\right)\)
=> nO2 = 0,04 (mol)
=> VO2 = 0,04.22,4 = 0,896(l)

2KClO3-to\xt->2KCl+3O2
0,1------------------0,1
n KClO3=\(\dfrac{12,25}{122,5}\)=0,1 mol
=>m KCl=0,1.74,5=7,45g
H=\(\dfrac{6,8}{7,45}.100\)=91,275%
b)
2KClO3-to\xt->2KCl+3O2
0,2-------------------------0,3 mol
n O2=\(\dfrac{6,72}{22,4}\)=0,3 mol
H=85%
=>m KClO3=0,2.122,5.\(\dfrac{100}{85}\)=28,82g
c)
2KClO3-to\xt->2KCl+3O2
0,2------------------------0,3
n KClO3=\(\dfrac{24,5}{122,5}\)=0,2 mol
H=80%
=>m O2=0,3.32.\(\dfrac{80}{100}\)=10,4g

a) PTHH:
2KNO3→2KNO2 + O2
b)\(n_{O_2}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\)Theo PTHH ta có:
nKNO3=2nO2=0,15(mol)
mKNO3 ban đầu=0,15.101=15,15(g)
mKNO3 thực tế=15,15.\(\dfrac{85}{100}\)=12,8775(g)

Theo định luật bảo toàn khối lượng, ta có khối lượng khí oxi thu được là:
m O 2 = 24,5 – 13,45 = 11,05(g)
Khối lượng thực tế oxi thu được: m O 2 = (11,05 x 80)/100 = 8,84 (g)

Theo định luật bảo toàn khối lượng ta có: m O 2 = 15,8 – 12,6 = 3,2(g)
Hiệu suất của phản ứng phân hủy: H = 2,8/3,2 x 100 = 87,5%

2KMnO4 \(\underrightarrow{t^o}\) K2MnO4 + MnO2 + O2
nO2 cần điều chế = 67,2 : 22,4 = 3 mol
=> nKMnO4 cần dùng = 2nO2 = 6 mol
Nhưng hiệu suất phản ứng chỉ đạt 80% nên nKMnO4 thực tế cần dùng là 6:80% = 7,5 mol
<=> mKMnO4 = 7,5.158 = 1185 gam = 1,185 kg
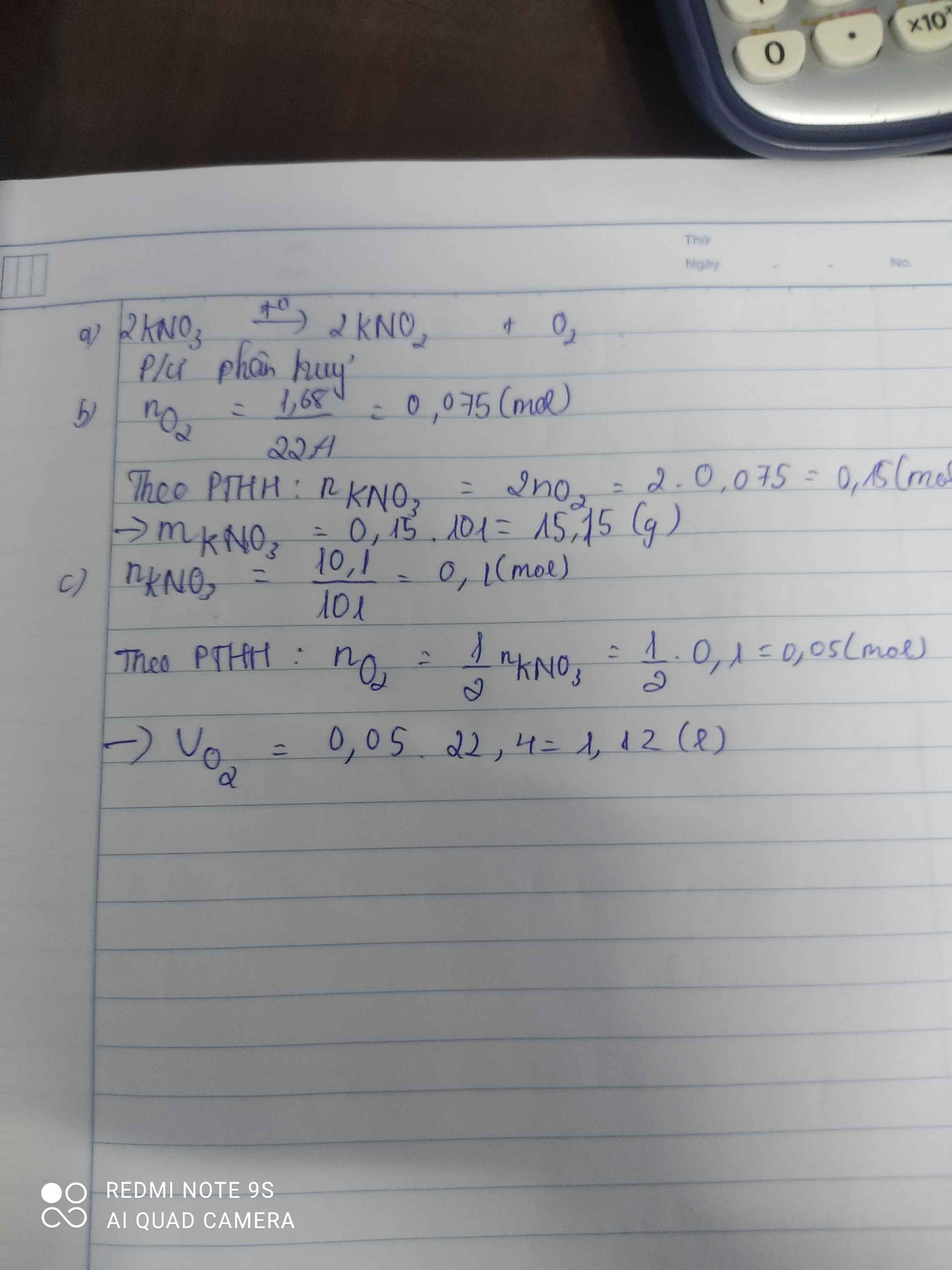

\(PTHH:2KNO_3\overset{t^0}{\rightarrow}2KNO_2+O_2\)
\(a,n_{O_2}=\frac{11,2}{32}=0,35mol\)
\(\Rightarrow n_{KNO_3}=\frac{0,35}{80}.101=44,1875g\)
\(b,n_{KNO_3}=\frac{40,4}{101}=0,4mol\)
\(\Rightarrow m_{O_2}=0,4.32.85\%=10,88g\)