Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

VO2(pư)=1/5Vkk=8.4(l).theo bài ra ta có nCO2+N2=44.8/22.4=2(1)lại có dB/H2=15=>nCO2/nN2=1/7(2).từ (1)và(2)=>nCO2=0.25(mol)và nN2=1.75(mol).
áp dụng ĐLBTKL ta có m=mCO2+mH2O+mN2-mO2(pư)=57(gam).ta lại có mC+mH+mN=nCO2.12+2.nH2O+28.nN2=53(gam) <57(gam)=>trong A có nguyên tố oxi mO=57-53=4(gam).gọi CTĐGN của A là CxHyOzNt ta có:x:y:z:t=nCO2:2nH2O:nO:2nN2=1:4:1:14=>CTĐGN của A:CH4ON14.lại có 12n+4n+16n+196n=600(tớ nghĩ phải là 600 chứ A chứa nhiều nguyên tố lắm)=>n=3=>CTHH của A:C3H12O3N42.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 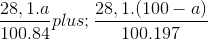 = 0,2
= 0,2
=> a = 29,89.

Ta có mC = 0,75m (gam) > 0,7m (gam)
\(\Rightarrow\) trong C có Fe dư
\(\Rightarrow\) HNO3 hết, trong B chỉ chứa muối Fe(NO3)2
PT:
Fe + 4HNO3 \(\rightarrow\)Fe(NO3)3 + NO + 2H2O
Fe + 6HNO3 \(\rightarrow\) Fe(NO3)3 + 3NO2 + 3H2O
Fe + 2Fe(NO3)3 \(\rightarrow\) 3Fe(NO3)2
Ta có : \(n_{hh}=\frac{2,87.1,2}{0,082.\left(273+27\right)}=0,14mol\)
\(\Rightarrow\) số mol HNO3 tạo muối = 0,44 – 0,14 = 0,3 (mol)
\(\Rightarrow\) \(n_{Fe\left(NO_3\right)_2}=0,15mol\)
\(\Rightarrow\) Khối lượng muối trong B = 0,15.180 = 27 (gam)
\(\Rightarrow\) nFe (pu) = 0,15 (mol) => mFe(pu) = 0,15.56 = 8,4 (gam)
\(m=\frac{8,4.100}{25}=33,6\left(g\right)\)



Chọn C
2Cu(NO3)2 → t ° 2CuO + 4NO2↑+ O2↑ (1)
2x →4x → x (mol)
4Fe(NO3)2 → t ° 2Fe2O3 + 8NO2↑ + O2↑ (2)
4y → 8y → y (mol)
4NO2 + O2 + 2H2O → 4HNO3 (3)
Ta thấy ở PTHH (1) và (3): nNO2: nO2 = 4: 1
ở PTHH (2) nNO2 : nO2 = 8 : 1
=> số khí thoát ra chính là khí NO2 dư ở PTHH (2)
=> nNO2 = 0,448 : 22,4 = 0,02 (mol)
=> 4y = 0,02 => y = 0,005 (mol)
BTKL: mhh = 188.2x + 180.4y = 20,2
=> x= 0,044 (mol)
=> nHNO3 = 2nCu(NO3)2 + 2nFe(NO3)2 – nNO2 dư = 2. 2.0,044 + 2. 4.0,005 – 0,02 = 0,196 (mol)
=> CM HNO3 = 0,196 : 2 = 0,098 (M)
=> pH = -log [HNO3] = 1