Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Điện phân 125 ml dung dịch X có 6,4 gam kim loại ở catot
Suy ra :
Điện phân 250 ml dung dịch X có \(\dfrac{250.6,4}{125} = 12,8\) gam kim loại ở catot
\(\Rightarrow m_{halogenua} = 27 - 12,8 = 14,2(gam)\\ \Rightarrow m_{Ag(trong\ kết\ tua)} = 57,4 - 14,2 = 43,2\\ \Rightarrow n_{Ag} = \dfrac{43,2}{108} = 0,4(mol)\)
CTHH của kết tủa : AgX
\(\Rightarrow M_{AgX} = 108 + X = \dfrac{57,4}{0,4} = 143,5 \\ \Rightarrow X = 35,5(Cl)\)
X: RCln
\(n_{Cl} = 0,4 \Rightarrow n_{muối} = \dfrac{0,4}{n}(mol)\\ \Rightarrow M_{muối} = R + 35,5n = \dfrac{27}{\dfrac{0,4}{n}} = 67,5n\\ \Rightarrow R = 32n\)
Với n = 1 thì R = 64(Cu)
Vậy muối là CuCl2

Gọi muối là RXn (X ≠≠ F)
\(RXn+nAgNO_3\rightarrow R\left(NO_3\right)_n+nAgX\)
\(n_{AgX}=\frac{57,4}{108+X}\left(mol\right)\)
Mặt khác:
\(2RXn\rightarrow2R+nX_2\)
\(n_R=n_{RXn}=\frac{6,4}{R}\)
Lượng muối điện phân bằng 1/2 lượng muối td AgNO3
\(\rightarrow\frac{12,8}{R}=\frac{57,4}{108n+Xn}\)
\(\Leftrightarrow57,4R=1382,4n+12,8Xn\left(1\right)\)
Mặt khác, m muối= 27g
\(M_{muoi}=\frac{27.\left(108n+Xn\right)}{57,4}\)
\(\Leftrightarrow57,4R+57,4Xn=2916n+27Xn\)
\(\Leftrightarrow30,4Xn+57,4R=2916n\left(2\right)\)
Với n=1; giải hệ (1)(2)\(\rightarrow\) R= 32 (S), X= 35,5 (Cl) (loại)
Tương tự n= 2; 3 không có kết quả (??)

Đáp án C
Gọi công thức muối cần tìm là MX2.
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
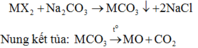
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
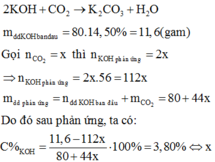 = 0,75
= 0,75

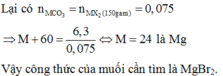

a/ PTHH: R + 2HCl ===> RCl2 + H2
nH2 = 2,688 / 22,4 = 0,12 (mol)
nR = nH2 = 0,12 mol
=> MR = 6,72 / 0,12 = 56 (g/mol)
=> R là Fe

\(n_{AgCl}=n_{AgNO3}=0,24\left(mol\right)\)
Muối clorua + AgNO3 \(\rightarrow AgCl\downarrow+\) muối Y
\(m_{AgNO3}=40,8\left(g\right)\)
Vậy mmuối Y = \(11,88+40,8-34,44=18,24\left(g\right)\)
phần pt là sao z bạn mk ko hiểu lắm bạn có thể giải thích phần pt dc k

a,
- Giả sử X là F (không tạo kết tủa) \(\Rightarrow\) Y là Cl.
\(AgNO_3+NaCl\rightarrow NaCl+AgNO_3\)
\(\rightarrow n_{NaCl}=n_{AgCl}=0,331\left(mol\right)\)
\(\Rightarrow m_{NaCl}=19,36< 22\left(g\right)\left(TM\right)\)
- Giả sử X, Y đều tạo kết tủa. Gọi chung là R.
nNaR= nAgR
\(\Rightarrow\frac{22}{23+R}=\frac{47,5}{108+R}\)
\(\Leftrightarrow47,5\left(23+R\right)=22\left(108+R\right)\)
\(\Leftrightarrow R=50,3\left(Cl;Br\right)\left(TM\right)\)
Vậy NaX, NaY có thể là NaF, NaCl hoặc NaCl, NaBr.
b,
- Trường hợp NaF, NaCl:
mNaCl= 19,36g
\(\Rightarrow C\%_{NaCl}=\frac{19,36.100}{200}=9,68\%\)
\(m_{NaF}=22-19,36=2,64\left(g\right)\)
\(\Rightarrow C\%_{NaF}=\frac{2,64.100}{200}=1,32\%\)
Trường hợp NaCl, NaBr
Gọi x là mol NaCl; y là mol NaBr
Bảo toàn nguyên tố, n muối= n kết tủa
\(\Rightarrow58,5x+103y=22;143,5x+188y=47,5\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
\(C\%_{NaCl}=\frac{0,2.58,5.100}{200}=5,85\%\)
\(C\%_{NaBr}=\frac{0,1.103.100}{200}=5,15\%\)


