
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1 đốt
2 cô cạn
3 2,3
4 hạt proton
5 đơn vị cacbon ( đvc )
6 proton electron
7 electron
8 4 . 48335 x 10-23
9 số hạt proton bằng số hạt electron
10 vì khối lượng của electron ko đáng kể
11 proton , nơtron , electron
12 có cùng số proton trog hạt nhân (các nguyên tử cùng loại )
13 sắt , chì , kẽm , thủy ngân
14 Oxi , nitơ , cacbon , clo
15 2 đơn chất 4 hợp chất
16 Fe , O2 , Cl2 , P , Na
17 Na2O , HNO3 , CO2 , CaO , BaCl2
18 342 đvc
19 2O2
20 HNO3
21 P2O5
22 2 nguyên tử Al , 3 nguyên tử S , 4 nguyên tử O
23 CaO , Al2O3 , K2OO
24 Ba3 (PO4)2
25 CO3
26 XY
27 X3Y2
bn nhé

tờ cuối cùng câu 44: 17928. 10^-24 gam, hình như là C (tớ k nhìn rõ các ý,nó hơi mờ)
nguyễn thanh hiền: nguyên tử bạc thì có 108 nguyên tử khối
mà 1đvC=1,66.10^-24
=> 108đvC = 17928.10^-24 (nhân 108 .1,66)
(theo tớ là thế, vì tớ mới học nên k chắc lắm,nếu sai cho tớ xl)
câu 14 tờ đầu ý a

1.C
2.A
3.D
4.A
5.
(1)Khối lượng
(2)Tham gia
(3)Khối lượng
(4)Sau
6.
(1)a,d
(2)b,c,e
II.Tự luận
Câu 1.
1.
a;
VNH3=0,25.22,4=5,6(lít)
b;
nCO2=0,5(mol)
VCO2=0,5.22,4=11,2(mol)
c;
nO2=\(\dfrac{0,6.10^{23}}{6.10^{23}}=0,1\left(mol\right)\)
VO2=22,4.0,1=2,24(lít)
2.
Số phân tử H2S là:
\(\dfrac{0,6.10^{23}.2}{3}\)=0,4.1023(phân tử)
nH2S=\(\dfrac{0,4.10^{23}}{6.10^{23}}=\dfrac{1}{15}\)
VH2S=34.\(\dfrac{1}{15}\)=\(\dfrac{34}{15}\)(lít)
Câu 2(3,5 điểm)
Gọi CTHH của X là CxOy
PTK của X là 32.0,875=28(dvC)
x=\(\dfrac{28.42,857\%}{12}=1\)
y=\(\dfrac{28.57,143\%}{16}=1\)
Vậy CTHH của X là CO
Fe2O3 + 3CO -> 2Fe + 3CO2
Áp dung ĐLBTKL cho cả bài ta có:
mFe2O3+mCO=mFe+mCO2
=>a=mCO=11,2+13,2-16=8,4(g)



Bài 1 :
a) ta có PTHH :
\(Fe\left(OH\right)3-^{t0}->Fe2O3+H2O\)
b) Áp dụng ĐLBTKl ta có :
m(tạp chất trong Fe(OH)3 ) = mFe2O3 + mH2O = 160 + 54 = 214(g)
=> %m(tạp chất) = \(\dfrac{214}{400}.100\%=53,5\%\)
Bài 2 :
a) Ta có PTHH :
\(2Al\left(OH\right)3-^{t0}->Al2O3+3H2O\)
b) Áp dụng ĐLBTKL ta có :
mAl(OH)3 = mAl2O3 + mH2O
=> m(tạp chất chứa trong Al(OH)3 ) = 80 + 27 = 107 (g)
=> %m(Al(OH)3 bị phân hủy ) = \(\dfrac{107}{200}.100\%=53,5\%\)

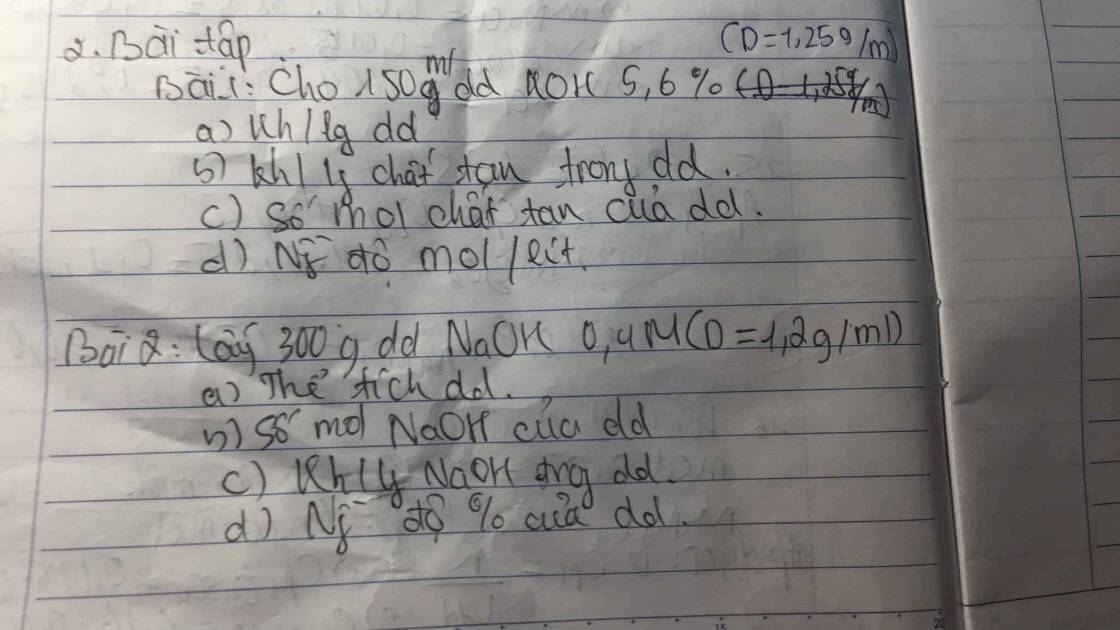





















 m. Giúp mk vs ạ
m. Giúp mk vs ạ



 Đề cg hóa
Đề cg hóa










 Mong các bạn giúp đỡ nhanh ạ
Mong các bạn giúp đỡ nhanh ạ



\(1.\\ a.m_{ddKOH}=150.1,25=187,5g\\ b.m_{NaOH}=\dfrac{187,5.5,6\%}{100\%}=10,5g\\ c.n_{KOH}=\dfrac{10,5}{56}=0,1875mol\\ d.150ml=0,15l\\ C_{M_{KOH}}=\dfrac{0,1875}{0,15}=1,25M\)
\(2.\\ a.V_{ddNaOH}=\dfrac{300}{1,2}=250ml=0,25l\\ b.n_{NaOH}=0,25.0,4=0,1mol\\ c.m_{NaOH}=0,1.40=4g\\ d.C_{\%NaOH}=\dfrac{4}{300}\cdot100\%=1,33\%\)