Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Lời giải:
CH2=CH2 + Br2 → C2H4Br2 (1)
P.ư: →
(mol)
HC=CH + 2Br2 → Br2CH-CHBr2 (2)
P.ư: → 2.
(mol)
Từ (1) và (2) ta thấy số mol Br2 phản ứng với C2H2 gấp 2 lần số mol Br2 phản ứng với C2H4
Vì cùng một dung dịch brom nên thể tích dung dịch brom cần là 50 x 2 = l00ml.
Giải:
Ta có:\(n_{C_2H_4}=\dfrac{0.1}{22,4}=\dfrac{1}{224}\left(mol\right)\)
\(C_2H_4\) + Br2 → C2H4Br2 (1)
số mol Br2 phản ứng với C2H2 gấp 2 lần số mol Br2 phản ứng với C2H4
Vì cùng một dung dịch brom nên thể tích dung dịch brom cần là 50 x 2 = 100ml.

\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\left(1\right)\\ C_2H_2+2Br_2\rightarrow C_2H_2Br_4\left(2\right)\)
Số mol tỉ lệ thuận thể tích. Ta thấy:
\(V_{C_2H_4}=V_{C_2H_2}\\ \Rightarrow V_{Br_2\left(2\right)}=2.V_{Br_2\left(1\right)}=2.50=100\left(ml\right)\)
Ta chọn C
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\\PT\Rightarrow n_{Br_2}=n_{C_2H_4}\\ C_2H_2+2Br_2\rightarrow C_2H_2Br_4\\ PT\Rightarrow n_{Br_2}=2n_{C_2H_2}\\ Tacó: n_{C_2H_4}=n_{C_2H_2}\left(doV_{C_2H_4}=V_{C_2H_2}\right)\)
Mà 0,1 lít khí etilen (đktc) làm mất màu tối đa 50 ml dung dịch brom
=> 0,1 lít khí axetilen (đktc) thì có thể làm mất màu tối đa thể tích dung dịch brom trên là 100ml

\(n_{Br_2}=\dfrac{5,6}{160}=0,035\left(mol\right)\)
PTHH: C2H2 + 2Br2 --> C2H2Br4
0,0175<-0,035
=> \(\%V_{C_2H_2}=\dfrac{0,0175.22,4}{0,56}.100\%=70\%\)
=> %VCH4 = 100% - 70% = 30%
=> B

a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Ta có: \(n_{C_2H_4}+n_{C_2H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\left(1\right)\)
Theo PT: \(n_{Br_2}=n_{C_2H_4}+2n_{C_2H_2}=\dfrac{48}{160}=0,3\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,2.22,4}{5,6}.100\%=80\%\\\%V_{C_2H_2}=20\%\end{matrix}\right.\)
b, \(V_{ddBr_2}=\dfrac{0,3}{0,25}=1,2\left(M\right)\)

\(n_{hh\left(CH_4,C_2H_4\right)}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\\ n_{Br_2}=\dfrac{4}{160}=0,025\left(mol\right)\\ C_2H_4+Br_2\rightarrow C_2H_4Br_2\\ n_{C_2H_4}=n_{Br_2}=0,025\left(mol\right)\)
Vì số mol tỉ lệ thuận với thể tích, nên ta có:
\(\%n_{C_2H_4}=\dfrac{0,025}{0,25}.100\%=10\%\\ \Rightarrow\%V_{C_2H_4}=10\%;\%V_{CH_4}=100\%-10\%=90\%\)

Dẫn 2 khí qua dung dịch nước brom chỉ có C 2 H 4 phản ứng
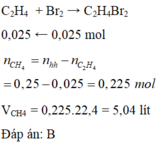



1, C2H2
C2H2+ 2Br2-> C2H2Br4
2, C2H4+Br2-> C2H4Br2 (1)
0,1 (l)...50(ml)
C2H2+2Br2-> C2H2Br4 (2)
0,1 (l)...100 (ml)
3, nhh= \(\dfrac{0,56}{22,4}=0,025\left(mol\right)\), n Br2pư =\(\dfrac{5,6}{160}=0,035\)
C2H2 + 2Br2 -> C2H2Br4
0,0175.......0,035 (mol)
==> nCH4= 0,025-0,0175=0,0075 (MOL)
==> %V=%nCH4=\(\dfrac{0,0075}{0,025}.100\%=30\%\)
==> %VC2H2 = 100%-30%=70%
vậy...........