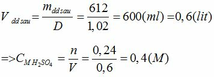Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

A, Gọi X,y lần lượt là số mol của Mg và Al
Pthh:
Mg + H2SO4---> MgSO4 + H2
X. X. X. X
2Al + 3H2SO4---> Al2(SO4)3+3H2
Y. 1.5y. Y. 1.5y
Ta có pt:
24x + 27y= 1.95
X+1.5y=2.24/22.4=0.1
=> X=0.025, Y=0.05
%Mg= 0.025×24×100)/1.95=30.8%
%Al= 100%-30.8%=69.2%
mH2SO4= 0.025+1.5×0.05=0.1g
mH2= (0.025+0.05)×2=0.15g
C, Mdd H2SO4 = 0.1/6.5×100=1.54g
MddY= 1.54+1.95-0.15=3.34g
%MgSO4 vs %Al2(SO4)3 b tự tính nha

2Al + 3H2SO4 => Al2(SO4)3 + 3H2
x 1,5x
Zn + H2SO4 => ZnSO4 + H2
y y
27x + 65y = 9,2
1,5x + y = 5,6/22,4
=> x= 0,1 y= 0,1
%Al = 29,348%
%Zn = 70,652%

Fe3O4+4CO=>3Fe+ 4CO2
CuO+CO=>Cu+CO2
Cr B gồm Fe Cu
HH khí D gồm CO dư và CO2
CO2 +Ca(OH)2=>CaCO3+H2O
p/100 mol<= p/100 mol
2CO2+Ca(OH)2 => Ca(HCO3)2
p/50 mol
Ca(HCO3)2+ 2NaOH=>CaCO3+ Na2CO3+2H2O
p/100 mol p/100 mol
Tổng nCO2=0,03p mol=nCO
=>BT klg
=>m+mCO=mCO2+mB=>mB=m+0,84p-1,32p=m-0,48p
c) hh B Fe+Cu
TH1: Fe hết Cu chưa pứ cr E gồm Ag Cu
dd Z gồm Fe(NO3)2
Fe+2Ag+ =>Fe2+ +2Ag
TH2:Cu pứ 1p cr E gồm Cu và Ag
Fe+2Ag+ => Fe2+ +2Ag
Cu+2Ag+ =>Cu2+ +2Ag
Dd Z gồm 2 muối của Fe2+ và Cu2+

a/ Số mol của HCl = 0,425 x 2 = 0,85mol
Gọi x, y lần lượt là số mol của Al, Mg trong hỗn hợp
Giả sử kim loại phản ứng hết
2Al + 6HCl ===> 2AlCl3 + 3H2
x...........3x...............................1,5x
Mg + 2HCl ===> MgCl2 + H2
y..........2y...............................y
Lập các sô mol trên phương trình, ta có
27x + 24y = 7,5 <=> 27x + 18y < 7,5
<=> (3x + 2y ) x 9 < 7,5 => 3x + 2y < 0,833 (mol) < 0,85
Vì số mol HCl phản ứng bé hơn số mol HCl đầu, nên HCl dư
b/ Chuyển m (gam) CuO thành (m - 5,6) gam chất rắn => Giảm 5,6 gam
Vậy nCuO(pứ) = nO(bị khử) = 5,6 / 16 = 0,35 mol
H2 + CuO =(nhiệt)==> Cu + H2O
0,35...0,35(mol)
Ta có: \(\begin{cases}27x+24y=7,5\\1,5x+y=0,35\end{cases}\)
=> \(\begin{cases}x=0,1\\y=0,2\end{cases}\)
=> mAl = 0,1 x 27 = 2,7 gam
mMg = 7,5 - 2,7 = 4,8 gam

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
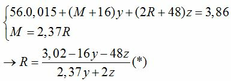
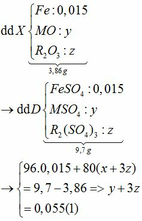
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

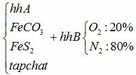
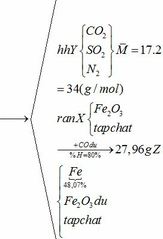
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
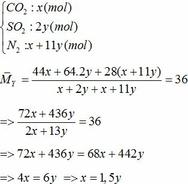
Khối lượng Fe có trong Z là:
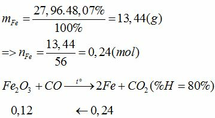
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
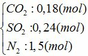
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
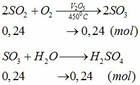
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)