Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo:
Quan sát thấy ống nghiệm có 2 lớp, lớp dưới là dung dịch KMnO4 trong nước màu tím, lớp trên là hexane không màu.

Tham khảo:
1. Ban đầu ống nghiệm có hai lớp, lớp dưới là bromine màu vàng, lớp trên là hexane không màu. Sau khi đặt ống nghiệm vào cốc nước nóng, thu được hỗn hợp không có màu.
2. Phương trình hoá học: Br2 + C6H14 \(\underrightarrow{t^o}\) C6H13Br + HBr.

Hiện tượng: Hexane bốc cháy có ngọn lửa màu vàng.
\(PTHH:2C_6H_{14}+19O_2\rightarrow\left(t^o\right)12CO_2+14H_2O\)

Tham khảo:
Ban đầu ống nghiệm có hai lớp, lớp dưới là bromine màu vàng, lớp trên là hexane không màu. Sau khi đặt ống nghiệm vào cốc nước nóng, thu được hỗn hợp không có màu.

Công thức cấu tạo các sản phẩm monobromo có thể tạo thành:
CH3 – CH2 – CH2 – CH2 – CH2 – CH2Br.
CH3 – CH2 – CH2 – CH2 – CHBr – CH3.
CH3 – CH2 – CH2 – CHBr – CH2 – CH3.

Nhận xét: Sẽ cho ra ngọn lửa màu vàng
PTHH: \(2C_6H_{14}+19O_2\rightarrow^{t^0}12CO_2+14H_2O\)

Tham khảo:
a) Trong ống nghiệm, nước nằm trong lớp chất lỏng ở phía dưới.
b) Ống nghiệm (2) chứa hexane, ống nghiệm (1) chứa hex-1-ene. Ở nhiệt độ thường hexane kém hoạt động nên không phản ứng làm mất màu dung dịch bromie, hex-1-ene là alkene làm mất màu vàng của nước bromine.

1. Trước khi chiết lớp hexane trong phễu không có màu; sau khi chiết lớp hexane trong phễu có màu vàng cam.
2. Thí nghiệm tách β-carotene từ nước cà rốt dựa theo nguyên tắc chiết lỏng – lỏng.
Dùng dung môi là hexane có khả năng hoà tan β-carotene nhưng không tan trong nước và có nhiệt độ sôi thấp để chiết.

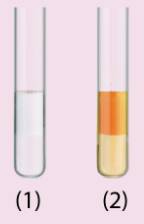
Tham khảo:
a) Hexane không phản ứng với dung dịch KMnO4 ở điều kiện thường. Do ở phân tử hexane chỉ có các liên kết đơn C – C và C – H, đó là các liên kết σ bền vững, vì thế hexane tương đối trơ về mặt hoá học, không phản ứng với chất oxi hoá mạnh như KMnO4.
b) Đốt cháy hexane trong bát sứ mà không nên đốt trong cốc thuỷ tinh do phản ứng này toả ra lượng nhiệt lớn có thể làm vỡ cốc thuỷ tinh.
- Phương trình hoá học minh hoạ:
C6H14+\(\dfrac{19}{2}\)O2\(^{ }\underrightarrow{t^o}\)6CO2+7H2O
c) Đốt cháy hexane trong điều kiện thiếu oxygen:
C6H14+\(\dfrac{13}{2}\)O2\(\underrightarrow{t^o}\)6CO+7H2O