Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TH1: Hóa trị `M` đổi `->M:\ Fe`
`Fe^0->Fe^{+2}+2e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `n_{Fe}=n_{H_2}=0,14(mol)`
`->n_{Cu}={11,2-0,14.56}/{64}=0,0525(mol)`
`Cu^0->Cu^{+2}+2e`
`Fe^0->Fe^{+3}+3e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2n_{Cu}+3n_{Fe}=2n_{SO_2}=0,525`
`->2.0,0525+3.0,14=0,525`
Nhận.
`->M` là Iron `(Fe).`
TH2: Hóa trị `M` không đổi.
`M` hóa trị `n`
Đặt `n_{Cu}=x(mol);n_M=y(mol)`
`M^0->M^{+n}+n.e`
`2H^{-1}+2e->H_2^0`
Bảo toàn electron: `ny=2n_{H_2}=0,28`
`->y={0,28}/n(mol)`
`M^0->M^{+n}+n.e`
`Cu^0->Cu^{+2}+2e`
`S^{+6}+2e->S^{+4}`
Bảo toàn electron: `2x+ny=2n_{SO_2}=0,525`
`->x={0,525-0,28}/2=0,1225(mol)`
`->m_M=11,2-0,1225.64=3,36(g)`
`->M_M={3,36}/{{0,28}/n}=12n`
`->n=2;M_M=24`
`->M` là magnesium `(Mg).`
Vậy `M` là `Mg` hoặc `Fe.`

\(a,\) Đặt \(\begin{cases} n_{Fe}=x(mol)\\ n_{Al}=y(mol) \end{cases}\Rightarrow 56x+27y=22(1)\)
\(n_{H_2}=\dfrac{17,92}{22,4}=0,8(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ 2Al+6HCl\to 2AlCl_3+3H_2\\ \Rightarrow x+1,5y=0,8(2)\\ (1)(2)\Rightarrow \begin{cases} x=0,2(mol)\\ y=0,4(mol) \end{cases} \Rightarrow \begin{cases} \%_{Fe}=\dfrac{0,2.56}{22}.100\%=50,91\%\\ \%_{Al}=100\%-50,91\%=49,09\% \end{cases} \)
\(b,\Sigma n_{HCl}=2n_{Fe}+3n_{Al}=0,4+1,2=1,6(mol)\\ \Rightarrow m_{dd_{HCl}}=\dfrac{1,6.36,5}{3,7\%}=1578,38\%\)

\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=6.95\left(g\right)\left(1\right)\)
\(n_{NO_2}=\dfrac{10.08}{22.4}=0.45\left(mol\right)\)
Bảo toàn e :
\(3a+3b=0.45\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.05,b=0.1\)
\(m_{Al}=0.05\cdot27=1.35\left(g\right)\)
\(m_{Fe}=0.1\cdot56=5.6\left(g\right)\)

Gọi $n_{Cu} = a(mol) ; n_{Al} = b(mol) \Rightarrow 64a + 27b = 3(1)$
$Cu^0 \to Cu^{+2} + 2e$
$Al^0 \to Al^{+3} + 3e$
$N^{+5} + 1e \to N^{+4}$
Bảo toàn electron :
$2a + 3b = 0,2(2)$
Từ (1)(2) suy ra $a = \dfrac{3}{115} ; b = \dfrac{17}{345}$
\(\%m_{Cu}=\dfrac{\dfrac{3}{115}.64}{3}.100\%=55,65\%\\ \%m_{Al}=100\%-55,65\%=44,35\%\)
Gọi số mol của Cu và Al lần lượt là x,y (mol) (x,y>0)
\(Cu+4HNO_{3\left(đ\right)}\underrightarrow{to}Cu\left(NO_3\right)_2+2NO_2+2H_2O\\ x..................................2x\left(mol\right)\\ Al+6HNO_{3\left(đ\right)}\underrightarrow{to}Al\left(NO_3\right)_3+3NO_2+3H_2O\\ y...............................3y\left(mol\right)\)
\(\left\{{}\begin{matrix}64x+27y=3\\2x+3y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=\dfrac{3}{115}\\y=\dfrac{17}{345}\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{\dfrac{3}{115}.64}{3}.100\approx55,652\%\\\%m_{Al}\approx44,348\%\end{matrix}\right.\\ \)


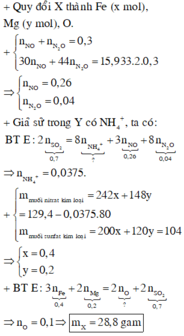

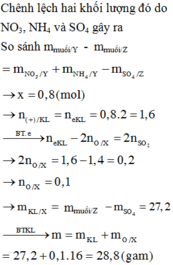
Gọi số mol Al và Fe lần lượt là a;b
$\Rightarrow 27a+56b=8,3$
Bảo toàn e ta có: $3a+3b=0,6$
Giải hệ ta được $a=b=0,1$
$\Rightarrow m_{Al}=2,7(g);m_{Fe}=5,6(g)$
\(n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m=27a+56b=8.3\left(g\right)\left(1\right)\)
\(n_{SO_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(BTe:\)
\(3a+3b=0.3\cdot2=0.6\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(m_{Al}=0.1\cdot27=2.7\left(g\right)\)
\(m_{Fe}=5.6\left(g\right)\)