Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe + CuSO4 → FeSO4 + Cu
1mol 1 mol => tăng 8 gam
x mol x mol tăng 0,8gam
=> x= 0,8:8= 0,1 mol
=> CM ( dung dịch CuSO4) = 0,1:0,2= 0,5 M
Bài 3 :
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu|\)
1 1 1 1
x 0,1 x
Gọi x là số mol của Fe
Vì khối lượng của sắt tăng so với ban đầu nên ta có phương trình :
\(m_{Cu}-m_{Fe}=0,8\left(g\right)\)
64x - 56x = 0,8
8x = 0,8
⇒x = \(\dfrac{0,8}{8}=0,1\)
\(n_{CuSO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddCuSO4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Chúc bạn học tốt

Gọi a là số mol C u S O 4 tham gia phản ứng
Phương trình hóa học:
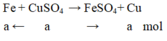
Theo đề bài ta có: m C u b á m v à o – m F e tan r a = m K L t ă n g
64a – 56a = 0,8 ⇒ a = 0,01 mol
Nồng độ dung dịch C u S O 4 là: C M = n V = 0,01 0,2 = 0,5 M
⇒ Chọn C.

PTHH: Fe + CuSO4 --> FeSO4 + Cu
______a------------------------------>a
=> 64a - 56a = 0,2
=> 0,025 (mol)
=> mFe(pư) = 0,025.56 = 1,4 (g)
=> mCu = 0,025.64 = 1,6 (g)

Đặt nFe(pứ)=a(mol)
PTHH Fe +CuSO4------>FeSO4+Cu
Theo phương trình =>nFe=nCu=a(mol)
mđinh sắt tăng=mcu-mFe=64a-56a=0,2(g)
=>a=0,025(mol)
=>mFe(pứ)=0,025.56=1,4(g)
mCu=0,025.64=1,6(g)

a) Fe +CuSO4 --> FeSO4 +Cu (1)
mkim loại tăng=2(g)
giả sử nFe sinh ra=x(mol)
theo (1) : nCu=nFe=x(mol)
=>\(64x-56x=2=>x=0,25\left(mol\right)\)
=>mFe=14(g)
mCu=16(g)
b)nCuSO4=\(\dfrac{400.16}{100.160}=0,4\left(mol\right)\)
theo (1) : nFeSO4=nCuSO4=nFe=0,25(Mol)
=>nCuSO4(dư)=0,15(mol)
CuSO4 +Ba(OH)2 --> BaSO4+Cu(OH)2 (2)
FeSO4 +Ba(OH)2 --> BaSO4 +Fe(OH)2 (3)
theo (2) : nBa(OH)2(2)=nBaSO4(2)=nCu(OH)2=nCuSO4(dư)=0,15(mol)
theo (3) : nBa(OH)2(3)=nBaSO4(3)=nFe(OH)2=nFeSO4=0,25(mol)
=>\(\Sigma nBaSO4=0,4\left(mol\right)\)
=>mD=0,4.233+0,15.98+0,25.90=130,4(g)
nBa(OH)2=\(\dfrac{600.17,1}{100.171}=0,6\left(mol\right)\)
=>nBa(OH)2(dư)=0,2(mol)
mBa(OH)2(dư)=34,2(g)
mdd sau pư=600+0,15.160+0,25.152=662(g)
=>C%dd E=\(\dfrac{34,2}{662}.100=5,166\left(\%\right)\)

Fe + CuSO4 = FeSO4 + Cu
Sau phản ứng khối lượng thanh sắt tăng lên, chứng tỏ có 1 lượng Cu bám lên thanh sắt.
Khối lượng Cu phản ứng là: 16,4 - 15,6 = 0,8 (g)
Số mol Cu là: 0,8 : 64 = 0,0125 (mol)
Theo PTHH: n Fe= nCu = 0,0125 (mol)
Khối lượng sắt tham gia phản ứng là: 0,0125 x 56 = 0,7(g)

Fe + C u S O 4 → Cu + F e S O 4
Theo phương trình cứ 56 gam (1 mol) Fe tan vào 1 mol dung dịch C u S O 4 thì có 64 gam (1 mol) Cu được tạo ra, bám vào thanh sắt làm tăng 8 gam.
Khối lượng đinh sắt tăng 0,8 gam => nCuSO4 = 0,1 mol
Nồng độ mol dung dịch CuSO4 là = 0,1/0,2 = 0,5M.

bài 1
(1)Fe + CuSO4 →→ FeSO4 + Cu
(2)Fe + 2HCl →→ FeCl2 + H2
(3)FeSO4 + 2NaOH →→ Fe(OH)2 + Na2SO4
a) rắn A có Fe dư và Cu
Cho vào HCl dư rắn ko phản ứng là Cu
Theo (1) : nCu = nCuSO4 = 1.0,01 = 0,01 (mol)
→→ mCu = 0,01 . 64 =0,64 (g)
b) Dd B là FeSO4
Theo (1) : nFeSO4 = nCuSO4 = 0,01 (mol)
Theo (3) nNaOH = 2nFeSO4 = 2.0,01 = 0,02 (mol)
VNaOH = 0,02 : 1 = 0,02 (l)\
bài 2
Fe+CuSO4-->FeSO4+Cu
x-----x--------------------x
mtăng=mCu-mFepư=64x-56x=0,8
->x=0,1
CmCuSO4=0,1\0,2=0,5 M