Cho 5.4 gam nhôm tác dụng với dung dịch H2SO4 loãng thu được V lít(dktc)khí hidro.Tính V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Vì Ag không tác dụng với H2SO4 loãng
Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,3 0,45
\a) Chất rắn không tan là Ag nên :
\(m_{Ag}=5,4\left(g\right)\)
⇒ \(m_{Al}=13,5-5,4=8,1\left(g\right)\)
0/0Al = \(\dfrac{8,1.100}{13,5}=60\)0/0
0/0Ag = \(\dfrac{5,4.100}{13,5}=40\)0/0
b) Có : \(m_{Al}=8,1\left(g\right)\)
\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
\(n_{H2}=\dfrac{0,3.3}{2}=0,45\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,45.22,4=10,08\left(l\right)\)
Chúc bạn học tốt

\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ a.2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\\ b.n_{H_2SO_4}=0,4.1=0,4\left(mol\right)\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Vì:\dfrac{0,2}{2}< \dfrac{0,4}{3}\\ \Rightarrow H_2SO_4dư\\ \Rightarrow n_{H_2}=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,3.22,4=6,72\left(l\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
a) Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,2 0,3
\(n_{H2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
b) 400ml = 0,4l
\(n_{H2SO4}=1.0,4=0,4\left(mol\right)\)
Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,2 0,4 0,3
Lập tỉ số so sánh : \(\dfrac{0,2}{2}< \dfrac{0,4}{3}\)
⇒ Al phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của Al
\(n_{H2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
Chúc bạn học tốt

Đáp án B
Xét giai đoạn m gam Fe tác dụng với dung dịch H2SO4 loãng:
Sơ đồ phản ứng :
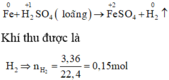
Các quá trình nhường, nhận electron :
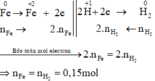
Xét giai đoạn m gam Fe tác dụng với H2SO4 đặc, nóng , dư:
Sơ đồ phản ứng:
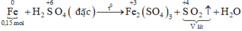
Các quá trình nhường, nhận electron:
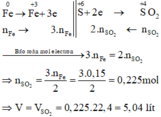

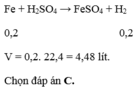
\(n_{Al}=\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
-PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
2 : 3 : 1 : 3
0,2 : 0,3 : 0,1 : 0,3
\(\Rightarrow V_{H_2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
Cíu tớ vơii