Cho 24,16 gam hỗn hợp gồm Cu và Fe3O4 tác dụng với HCl loãng dư thấy còn lại 6,4 gam Cu không tan. Mặt khác, hòa tan hoàn toàn 24,16 gam hỗn hợp X trong 240 gam dung dịch HNO3 31,5 % (dư) thu được dung dịch Y. Cho 600 ml dung dịch NaOH 2M vào dung dịch Y. Lọc bỏ kết tủa, cô cạn dung dịch sau đó nung đến khối lượng không đổi thu được 78,16 gam rắn khan. Nồng độ phần trăm của Cu(NO3)2 trong dung dịch Y có giá trị gần nhất với giá trị nào sau đây
A.11,6 B.11,65 C11,7 D.11,55

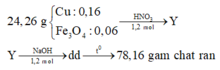
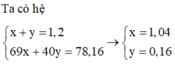
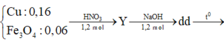
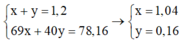
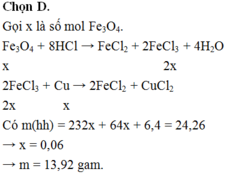



TN1: Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
2FeCl3 + Cu → CuCl2 + 2FeCl2
Vì Cu còn dư 0,1 mol nên sau phản ứng chứa FeCl2 : 3a mol, CuCl2 : a mol
→ a. 232 + 64. ( a + 0,1)= 24,16 → a = 0,06 mol
Vậy X gồm Cu: 0,16 mol và Fe3O4 : 0,06 mol
+ Nhận thấy nếu chất rắn chỉ chứa NaNO2 : 0,12 mol thì mchất rắn = 0,12. 69 > 78,16 gam.
⇒ Chất rắn chứa đồng thời NaNO2 : x mol và NaOH : y mol
Giả sử sản phẩm khử chứa N và O
Bảo toàn nguyên tố N → nN = 1,2 - 1,04 = 0,16 mol
Bảo toàn electron → 2nCu + nFe3O4 = 5nN - 2nO → nO = 0,21 mol
Bảo toàn khối lượng → mdd = 24,16 + 240 - 0,16.14 - 0,21. 16 = 258,56 gam
%Cu(NO3)2 =0.16*188/258,56 . 100% = 11,63%
Câu A hoặc B kq là 11,634%