Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt nFe3O4=a
Dung dịch X gồm a mol CuCl2 và 3a mol FeCl2 Fe3O4+8HCl --> FeCl2 + 2FeCl3+4H2O
Cu+ 2Fe3+ --> Cu2+ + 2Fe2+
mX=135a+127.3a=61,92g
=> a=0,12 Đặt nHNO3 dư = x
Dung dịch Y gồm 0,12 mol Cu(NO3)2 , 0,36 mol Fe(NO3)3 và x mol HNO3 (dư)
nNaOH dư = 1,5 - (0,12.2+0,36.3+x)=0,18-x
nNaNO3 = nNaOH pư = 1,5-(0,18-x) = 1,32+x
Hỗn hợp rắn sau nung gồm 1,32+x mol NaNO2 và 0,18-x mol NaOH
m rắn = 40(0,18-x)+69(1,32+x)=100,6
=> x= 0,08
Hỗn hợp khí thoát ra gồm có NO và NO2
Đặt nNO = a, nNO2 =b
Bảo toàn nguyên tố N : a+b=1,6-0,08-0,12.2-0,36.3=0,2
Bảo toàn e : 3a+b=0,12.2+0,12=0,36
=> a=0,08 , b=0,12
Bảo toàn khối lượng : mddY = mCu+mFe3O4+mddHNO3-m khí = 307,6 g
C%Fe(NO3)3= 0,36.242/307,6=28,32%
=> Đáp án B

Chọn đáp án C
Giả sử KOH tác dụng với X thì KOH hết ⇒ n KNO 3 = n KOH = 0 , 5 mol.
⇒ m KNO 3 = 0 , 5 x 101 = 50 , 5 gam gam > 41,05 gam ⇒ vô lí ⇒ KOH dư.
Đặt n KOH dư = x mol; n KNO 3 = y mol
![]()
Phản ứng:
![]()
Giải hệ có: x = 0,05 mol; y = 0,45 mol
![]()
Đặt n Fe = a mol; n Cu = b mol ⇒ m A = 56 a + 64 b = 11 , 6 gam.
Do KOH dư ⇒ kết tủa hết ion kim loại ⇒ nung T thì rắn gồm Fe2O3 và CuO.
⇒ mrắn = 41,05 = 0,5a × 160 + 80b. Giải hệ có: a = 0,15 mol; b = 0,05 mol.
Quy hỗn hợp B về N và O. Bảo toàn nguyên tố nitơ có nN spk = 0,7 – 0,45 = 0,25 mol.
![]()
⇒ dung dịch chứa ion Fe2+, Fe3+ và H+ hết.!
Bảo toàn nguyên tố hidro có n H 2 O = 0 , 7 ÷ 2 = 0 , 35 mol.
⇒ bảo toàn nguyên tố oxi có nO sk = 0,7 × 3 – 0,45 × 3 – 0,35 = 0,4 mol.
⇒ BTKL mdung dịch sau phản ứng = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2 gam.
![]()

Đáp án B
Có m h h k h í = 6,11; n h h k h í = 0,13
=> n C l 2 = 0,05; n O 2 = 0,08.
Hòa tan hết Y trong HCl nên có: n H C l = 2. n H 2 O = 2. n O 2 - = 0,32 mol
- BTNT (Cl):
n C l - t r o n g Z = n A g C l = n H C l + n C l - = 0,32 + 0,1 = 0,42. → m A g C l = 0,42.143,5 = 60,27 gam
→ m k ế t t ủ a = m A g C l + m A g → m A g = 73,23 – 60,27 = 12,96 → n A g = 0,12 mol.
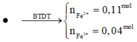
=> n F e 2 + = 0,12.
BTĐT trong Z: 2.0,12 + 2. n C u = 0,42 => n C u = 0,09.
Vậy X chứa Fe (0,12) và Cu(0,09).
Khi X tác dụng HNO3, ta thấy: (0,12 × 3 + 0,09 × 2) ÷ 3 = 0,18 mol > n N O = 0,15 mol
có nghĩa là Fe không lên hết Fe3+ mà có 1 phần chỉ lên Fe2+
Khi phản ứng với HNO3: nFe(III) = a mol ; nFe(II) = bmol. ta có hệ:
a + b = 0,12
3a + 2b + 0,09.2 = 0,15.3
Giải hệ: a = 0,03; b = 0,09.
Vì HNO3 dùng hết, n H N O 3 = 4 n N O = 0,6 mol → m H N O 3 = 37,8 → m d d H N O 3 = 120 gam.
→ BTKL: m d d T = m X + m H N O 3 - m N O = 127,98 gam.
% C F e ( N O 3 ) 3 t r o n g T = 0,03 . 242 : 127,98 ≈ 5,67%.

Chọn B.
Gọi a và b lần lượt là số mol của Fe và Cu. Xét hỗn hợp chứa 20 gam Fe2O3 và CuO ta có :
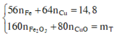
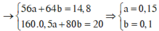
Dung dịch T gồm K+, Na+, OH- và NO3-. Khi nung chất rắn khan T thì :
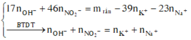

Dung dịch X gồm Fe2+, Fe3+, Cu2+(0,2 mol) và NO3- (với ). Xét X có:
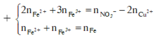
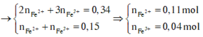
![]()
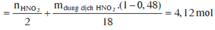
![]()
![]()

Chọn A.
Gọi a và b lần lượt là số mol của Fe và Cu. Xét hỗn hợp chứa 20 gam Fe2O3 và CuO ta có:
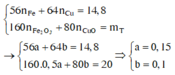
Dung dịch T gồm K+, Na+, OH- và NO3-. Khi nung chất rắn khan T thì:
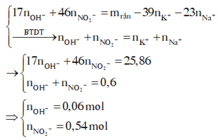
Dung dịch X gồm Fe2+, Fe3+, Cu2+(0,2 mol) và NO3-
(với n C O 3 - = n N O 2 - = 0 , 54 m o l ).
+ Xét X có:
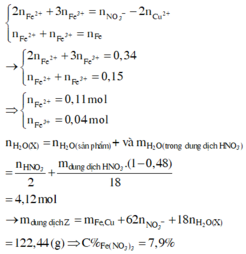
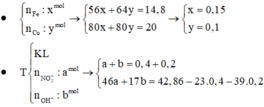
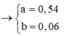

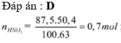
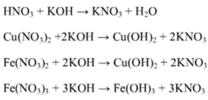
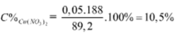

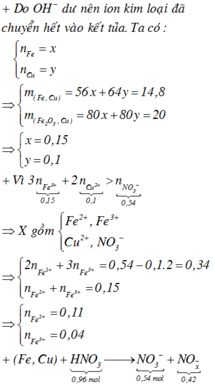
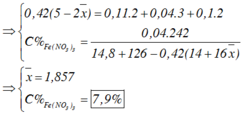
Chọn đáp án B
TN1: Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
2FeCl3 + Cu → CuCl2 + 2FeCl2
Vì Cu còn dư 0,1 mol nên sau phản ứng chứa FeCl2 : 3a mol, CuCl2 : a mol → a. 232 + 64. ( a + 0,1)= 24,16 → a = 0,06 mol
Vậy X gồm Cu: 0,16 mol và Fe3O4 : 0,06 mol
TN2: 24,26 g
78,16 gam chất rắn
+ Nhận thấy nếu chất rắn chỉ chứa NaNO2 : 0,12 mol thì mchất rắn = 0,12. 69 > 78,16 gam.
⇒ Chất rắn chứa đồng thời NaNO2 : x mol và NaOH : y mol
Ta có hệ
Giả sử sản phẩm khử chứa N và O
Bảo toàn nguyên tố N → nN = 1,2 - 1,04 = 0,16 mol
Bảo toàn electron → 2nCu + nFe3O4 = 5nN - 2nO → nO = 0,21 mol
Bảo toàn khối lượng → mdd = 24,16 + 240 - 0,16.14 - 0,21. 16 = 258,56 gam
%Cu(NO3)2 = 0 , 16 . 188 258 . 56 . 100% = 11,63%. ⇒ Chọn B