Câu 3: Cho m gam (sắt) Fe phản ứng với dd HCl dư thu được 0,336 lit khí H2(đktc) tính m.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Thể tích khí H2: 

 Số mol
Số mol
Phương trình:
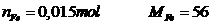


 khối lượng
khối lượng
Vậy m = 0,84gam

Fe+2HCl->FeCl2+H2
0,015-------------------0,015 mol
n H2=0,336\22,4=0,015 mol
=>m Fe=0,015.56=0,84g

PTHH: Zn + 2 HCl -> ZnCl2 + H2
nZn=13/65=0,2(mol)
nH2=nZnCl2=nZn=0,2(mol)
a) V(H2,đktc)=0,2.22,4=4,48(l)
b) nCuO= 24/80=0,3(mol)
PTHH: CuO + H2 -to-> Cu + H2O
Ta có: 0,3/1 > 0,2/1 => CuO dư, H2 hết, tính theo nH2
=> nCu=nH2=0,2(mol)
=> mCu=0,2.64=12,8(g)
c) 2 H2 + O2 -to-> H2O
nO2= 1/2 . nH2= 1/2 . 0,2=0,1(mol)
=> m(O2,đktc)=0,1.22,4=2,24(l)

Gọi $n_{Mg} = a(mol) ; n_{Fe} = b(mol)$
Muối gồm :
$Mg(NO_3)_2 : a(mol)$
$Fe(NO_3)_3 : b(mol)$
$\Rightarrow 148a + 242b = 49,1(1)$
Bảo toàn electron : $2n_{Mg} + 3n_{Fe} = 2a + 3b = n_{NO_2} = 0,65(2)$
Từ (1)(2) suy ra a = 0,25 ; b = 0,05
$\%m_{Mg} = \dfrac{0,25.24}{0,25.24 + 0,05.56}.100\% = 68,18\%$
$\%m_{Fe} = 100\% -68,18\% = 31,82\%$

a. PTHH:
Fe + 2HCl ---> FeCl2 + H2 (1)
Ta có: \(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
\(n_{HCl}=\dfrac{150}{1000}.2=0,3\left(mol\right)\)
Ta thấy: \(\dfrac{0,05}{1}< \dfrac{0,3}{2}\)
Vậy HCl dư.
Vậy trong X chứa FeCl2 và HCl dư.
b. PTHH:
2NaOH + FeCl2 ---> Fe(OH)2 + 2NaCl (2)
HCl + NaOH ---> NaCl + H2O (3)
Theo PT(1): \(n_{H_2}=n_{Fe}=0,05\left(mol\right)\)
=> \(V_{H_2}=0,05.22,4=1,12\left(lít\right)\)
c. Theo PT(1): \(n_{FeCl_2}=n_{Fe}=0,05\left(mol\right)\)
Theo PT(2): \(n_{Fe\left(OH\right)_2}=n_{FeCl_2}=0,05\left(mol\right)\)
=> \(m_{Fe\left(OH\right)_2}=0,05.90=4,5\left(g\right)\)

a)
Fe+ 2HCl→ FeCl2+H2↑
b)
nH2= 0,15 mol
⇒ nFe= 0,15 mol⇒ mFe= 0,15.56=8,4 g
c)\(CM_{HCl}=\frac{0,15.2}{0,15}\text{ = 2M}\)

1.
2M + 2xHCl \(\rightarrow\)2MClx + xH2
nH2=\(\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PTHH ta có:
nM=\(\dfrac{2}{x}\)nH2=\(\dfrac{0,6}{x}\)
MM=\(\dfrac{5,4}{\dfrac{0,6}{x}}=9x\)
Với x=3 thì MM=27
Vậy M là Al

Ta có: \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
a, PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
_____0,05__0,1____________0,05 (mol)
b, mFe = 0,05.56 = 2,8 (g)
c, mHCl = 0,1.36,5 = 3,65 (g)
\(\Rightarrow m_{ddHCl}=\dfrac{3,65}{10\%}=36,5\left(g\right)\)
Bạn tham khảo nhé!

Bạn nên thêm ↑ vào sau \(H_2\) nhé
Giải:
Phương trình:
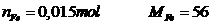


Vậy m = 0,84gam