Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đầu tiên là F fluorine số electon 19 stt 9 chu kì 2 nhóm VIIA
Thứ 2 là sodium số electon 23 stt 11 chu kì 3 nhóm IA
Cuối cùng là scandium số electon là 45 stt 21 chu kì 4 nhóm IIIB

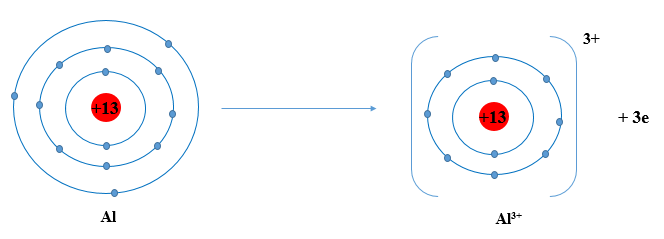
Aluminium (Al) thuộc ô số 13, chu kì 3, nhóm IIIA trong bảng tuần hoàn.
Nguyên tử aluminium nhường 3 electron ở lớp ngoài cùng để trở thành ion aluminium, kí hiệu Al3+
Sơ đồ tạo thành ion aluminium:

a) Theo đề bài ta có :
p+e+n=34 nên p+e=34-n
(p+e)-n=10 nên 34-n-n=10
Suy ra 2n=24
Vậy n=12
mà p=e
Nên p+e=2p
2p=34-12
2p=12
p=11
Vậy p=e=11; n=12
b) Bạn tự vẽ nhé ( nguyên tố đó x là Na (Sodium) vì p=11)
c) Nguyên tử khối : p+n=11+12=23 (amu)
d) Tên nguyên tố x đó là Na (Sodium)

- Nguyên tố X nằm ở chu kì 2, nhóm VA => Hàng số 2, cột VA
=> Nguyên tố phosphorus
+ Tên nguyên tố: Phosphorus
+ Kí hiệu hóa học: P
+ Khối lượng nguyên tử: 31
+ Ví trí ô của nguyên tố trong bảng tuần hoàn = số hiệu nguyên tử = 15
+ Ô nguyên tố có màu hồng => Phi kim

Cấu hình: 1s22s22p63s23p3
=> Vì e ngoài cùng điền ở phân lớp 3p, và có 5e lớp ngoài cùng
=> Nguyên tử nguyên tố này thuộc chu kì 3 và có 3 lớp e

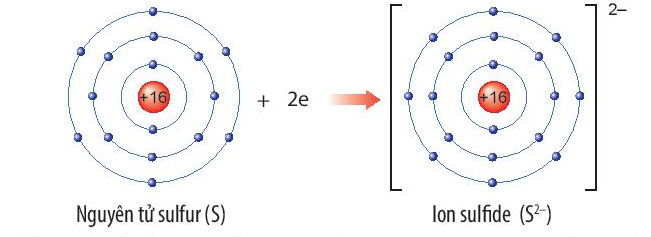
Nguyên tố sulfur (S) thuộc ô thứ 16, chu kì 3, nhóm VIA trong bảng tuần hoàn.
Nguyên tử sulfur nhận thêm 2 electron để trở thành ion ion sulfide (S2-). Ion sulfide (S2-) có 8 electron lớp ngoài cùng, sự phân bố electron trên ion sulfide (S2-) giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).

`1,`
Số electron lớp ngoài cùng của nguyên tử nguyên tố `Al` là `3`
Gt: Nguyên tố `Al` thuộc nhóm `IIIA`
Vì số nhóm `A` bằng số electron lớp ngoài cùng của các nguyên tử nguyên tố thuộc nhóm đó `-> Al` có `3e` lớp ngoài cùng.
Tương tự, `Cl` thuộc nhóm `VIIA ->` nguyên tố `Cl` có `7e` lớp ngoài cùng.
`2,`
Các nguyên tố thuộc chu kì và cùng nhóm với nguyên tố `Be:`
Chu kì: `Li, B, C, N, O, F, Ne`
Nhóm: `Mg, Ca, Sr, Ba, Ra`
1. Cấu hình e của Al (Z=13): 1s22s22p63s23p1
=> Có 3e lớp ngoài cùng (3e lớp thứ 3)
Cấu hình e của S (Z=16): 1s22s22p63s23p23p4
=> Có 6e lớp ngoài cùng (6e lớp thứ 3)

- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
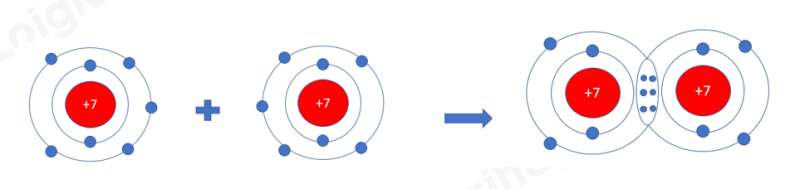
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
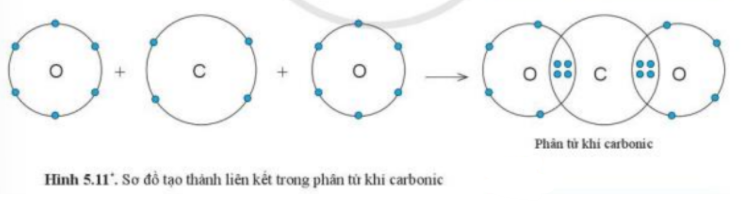
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung

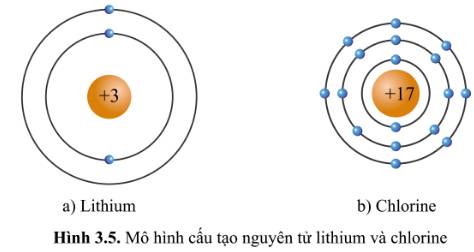
- Xét mô hình cấu tạo của nguyên tử lithium: có 1 hình tròn xanh ở vòng tròn ngoài cùng => Có 1 electron ở lớp vỏ ngoài cùng => Thuộc nhóm IA
- Xét mô hình cấu tạo của nguyên tử chlorine: có 7 hình tròn xanh ở vòng tròn ngoài cùng => Có 7 electron ở lớp vỏ ngoài cùng => Thuộc nhóm VIIA

- Nguyên tố carbon:
+ Có số hiệu nguyên tử: 6
+ Nằm ở chu kì 2 => Có 2 lớp electron
- Nguyên tố nhôm:
+ Có số hiệu nguyên tử: 13
+ Nằm ở chu kì 3 => Có 3 lớp electron

Để xác định số electron, khối lượng nguyên tử và các thông tin khác về nguyên tử A, ta có thể làm như sau:
1. Số electron (e):
- Nguyên tử A có số proton (p) là 13. Trong một nguyên tử trung hòa, số electron bằng số proton. Do đó, số electron của nguyên tử A cũng là 13.
2. Khối lượng nguyên tử (A):
- Khối lượng nguyên tử (A) được tính bằng tổng số proton và neutron.
- Số neutron (n) là 14.
- Khối lượng nguyên tử A = số proton + số neutron = 13 + 14 = 27.
3. Sơ đồ cấu tạo:
- Nguyên tử A có 13 electron, được phân bố như sau:
- Lớp 1: 2 electron
- Lớp 2: 8 electron
- Lớp 3: 3 electron
- Sơ đồ cấu tạo có thể được biểu diễn như sau:
```
Lớp 1: 2 e
Lớp 2: 8 e
Lớp 3: 3 e
```
4. Chu kỳ và nhóm:
- Với số proton là 13, nguyên tử A là nguyên tử của nguyên tố nhôm (Al).
- Nhôm (Al) nằm ở chu kỳ 3 và nhóm 13 trong bảng tuần hoàn.
Tóm lại:
- Số electron: 13
- Khối lượng nguyên tử A: 27
- Nguyên tố A là nhôm (Al), thuộc chu kỳ 3, nhóm 13.