Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những oxit bị khử là: Fe3O4, CuO
Pt: Fe3O4 + 4H2 → 3Fe + 4H2O
CuO + H2 → Cu + H2O
Chú ý: Nhiệt luyện là phương pháp dùng (H2, CO) khử các oxit kim loại trung bình (–K, Na, Ca, Ba, Mg, Al)

\(\left(K_2O,Al_2O_3,BaO\right)\underrightarrow{H_2O}\left(KOH,Ba\left(OH\right)_2\right),\left(Al_2O_3\right)\\ \left(Al_2O_3\right)\underrightarrow{dpnc}Al\\ \left(KOH,Ba\left(OH\right)_2\right)\underrightarrow{KHCO_3}\left(K_2CO_3,KHCO_3\right),\left(BaCO_3\right)\\ \left(BaCO_3\right)\underrightarrow{HCl}BaCl_2\underrightarrow{dp}Ba\\ \left(K_2CO_3,KHCO_3\right)\underrightarrow{HCl}\left(KCl\right)\underrightarrow{dp}K\\ K_2O+H_2O->2KOH\\ BaO+H_2O->Ba\left(OH\right)_2\\ Al_2O_3-dpnc->2Al+\dfrac{3}{2}O_2\\ KOH+KHCO_3->K_2CO_3+H_2O\\ Ba\left(OH\right)_2+2KHCO_3->BaCO_3+K_2CO_3+2H_2O\\ BaCO_3+2HCl->BaCl_2+H_2O+CO_2\\ BaCl_2-dp->Ba+Cl_2\\ K_2CO_3+2HCl->2KCl+H_2O+CO_2\\ KHCO_3+HCl->KCl+H_2O+CO_2\\ KCl-dp->K+\dfrac{1}{2}Cl_2\)

Thủy luyện là dùng kim loại mạnh đẩy kim loại yếu ra khỏi muối,
VỚi điều kiện kim loại mạnh đó phải đứng sau Mg trong dãy điện hóa.
=> A. 2AgNO3 + Zn → 2Ag + Zn(NO3)2
B. 2AgNO3 → 2Ag + 2NO2 + O2 ==> nhiệt phân muối
C. 4AgNO3 + 2H2O → 4Ag + 4HNO3 + O2 ==>đp dung dịch
D. Ag2O + CO → 2Ag + CO2. ==> nhiệt luyện
đáp án A dúng

Thủy luyện là dùng kim loại mạnh đẩy kim loại yếu ra khỏi muối,
VỚi điều kiện kim loại mạnh đó phải đứng sau Mg trong dãy điện hóa.
=> A. 2AgNO3 + Zn → 2Ag + Zn(NO3)2
B. 2AgNO3 → 2Ag + 2NO2 + O2 ==> nhiệt phân muối
C. 4AgNO3 + 2H2O → 4Ag + 4HNO3 + O2 ==>đp dung dịch
D. Ag2O + CO → 2Ag + CO2. ==> nhiệt luyện
Thủy luyện là dùng kim loại mạnh đẩy kim loại yếu ra khỏi muối,
VỚi điều kiện kim loại mạnh đó phải đứng sau Mg trong dãy điện hóa.
=> A. 2AgNO3 + Zn → 2Ag + Zn(NO3)2
B. 2AgNO3 → 2Ag + 2NO2 + O2 ==> nhiệt phân muối
C. 4AgNO3 + 2H2O → 4Ag + 4HNO3 + O2 ==>đp dung dịch
D. Ag2O + CO → 2Ag + CO2. ==> nhiệt luyện
đáp án A dúng

Axit tác dụng với kim loại : MgCl 2 , CuSO 4 (dùng H 2 SO 4 đặc).
Mg + 2HCl → MgCl 2 + H 2
Cu + 2 H 2 SO 4 (đặc) → CuSO 4 + SO 2 + H 2 O

b.
+ CO2: Nhận biết bằng dung dịch nước vôi trong \(\Rightarrow\) vẩn đục.
+ Etilen làm mất màu vàng của dung dịch brom.
Đốt cháy hai khí còn lại, đem sản phẩm qua dung dịch nước vôi trong thấy vẩn đục \(\Rightarrow\) Nhận biết được metan, còn lại là H2.
CH2 = CH2 + Br2 \(\rightarrow\) BrCH2 – CH2Br
CH4 + 2O2 \(\underrightarrow{t^o}\)CO2 + 2H2O
CO2 + Ca(OH)2 \(\rightarrow\) CaCO3\(\downarrow\) + H2O
2H2 + O2 \(\rightarrow\) 2H2O
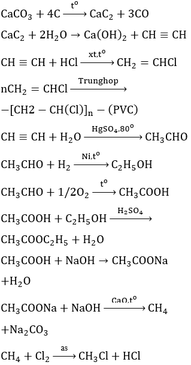
a. Phương trình hóa học:
\(\left(C_6H_{10}O_5\right)_n+n_{H_2O}\underrightarrow{axit,t^o}n_{C_6H_{12}O_6}\)
\(C_6H_{12}O_6\xrightarrow[30-32^oC]{men.rượu}2C_2H_5OH+2CO_2\)
\(C_2H_5OH+O_2\underrightarrow{men.giấm}CH_3COOH+H_2O\)
\(CH_3COOH+C_2H_5OH\xrightarrow[\leftarrow t]{H_2SO_4đ}CH_3COOC_2H_5+H_2O\)
\(PbO+C\underrightarrow{t^o}Pb+CO\)