
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

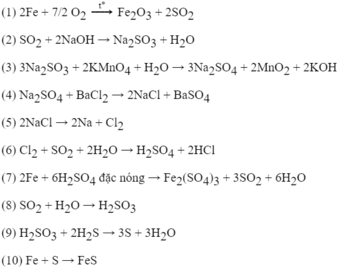

(1) S + H 2 → t ° H 2 S
(2) 2 H 2 S + 3 O 2 → t ° 2S O 2 + 2 H 2 O
(3) S O 2 + Br 2 + 2 H 2 O → t ° H 2 SO 4 + 2HBr
(4) Cu + H 2 SO 4 đặc nóng → Cu SO 4 + S O 2 + 2 H 2 O
(5) S O 2 + 2Mg → S + 2MgO
(6) S + O 2 → t ° S O 2
(7) S O 2 + 6HI → H 2 S + 3 I 2 + 2 H 2 O
(8) H 2 S + Cl 2 → S + 2HCl
(9) S + 6HN O 3 đặc nóng → H 2 SO 4 + 6N O 2 + 2 H 2 O

Câu1:
- Trích mẫu thử
- Cho quỳ tìm vào các mẫu thử
+ mẫu thử nào làm quỳ tím hóa đỏ là HCl
+ mẫu thử nào làm quỳ tím hóa xanh là NaOH
+ các mẫu thử còn lại không hiện tượng là NaCl,NaNO3,NaBr
- Cho dd \(AgNO_3\) tới dư vào các mẫu thử còn lại :
+ mẫu thử nào tạo kết tủa trắng là NaCl
NaCl+\(AgNO_3\) →AgCl↓+ \(NaNO_3\)
+ mẫu thử nào tạo kết tủa màu vàng nhạt là NaBr
NaBr+ \(AgNO_3\) →AgBr↓+ \(NaNO_3\)
+ mẫu thử nào không có hiện tượng là \(NaNO_3\)
Câu 2:
1. \(2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+5Cl_2\uparrow+8H_2O\)
2. \(Cl_2+2Na\underrightarrow{t^o}2NaCl\)
3. \(2NaCl\underrightarrow{đpnc}2Na+Cl_2\)
4.\(2HBr+Cl_2\rightarrow2HCl+Br_2\)
\(2NaI_{\left(lạnh\right)}+Br_2\rightarrow2NaBr+I_2\)
Câu 3 :
\(a) n_{Al} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 27a + 56b =1 1,1(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{6,72}{22,4} = 0,3(2)\\ (1)(2) \Rightarrow a = 0,1 ; b = 0,15\\ \%m_{Al} = \dfrac{0,1.27}{11,1}.100\% = 24,32\%\\ \%m_{Fe} = 100\% -24,32\% = 75,68\%\)
\(b) n_{HCl} = 2n_{H_2} = 0,3.2 = 0,6(mol)\\ \Rightarrow m_{dd\ HCl} = \dfrac{0,6.36,5}{14,6\%} = 150(gam)\\ m_{dd\ sau\ pư} = m_{hỗn\ hợp} + m_{dd\ HCl} - m_{H_2} = 11,1 + 150 - 0,3.2 = 160,5(gam)\\ n_{AlCl_3} = a = 0,1(mol)\ ;\ n_{FeCl_2} = b = 0,15(mol)\\ C\%_{AlCl_3} = \dfrac{0,1.133,5}{160,5}.100\% =8,32\%\\ C\%_{FeCl_2} = \dfrac{0,15.127}{160,5}.100\% = 11,87\%\)

\(n_{SO_2}=\dfrac{2,8}{22,4}=0,125mol\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
0,125 0,125 ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,25 0,125 ( mol )
\(m_{KMnO_4}=0,25.158=39,5g\)

a) Đặt CTTQ của khí halogen cần tìm là X2
PTHH: \(Ca+X_2\xrightarrow[]{t^o}CaX_2\)
b)
\(n_{X_2}=\dfrac{18,5925}{24,79}=0,75\left(mol\right)\)
Theo PT: \(n_{CaX_2}=n_{X_2}=0,75\left(mol\right)\)
\(\Rightarrow M_{CaX_2}=\dfrac{82,35}{0,75}=111\left(g/mol\right)\)
\(\Rightarrow M_X=\dfrac{111-40}{2}=35,5\left(g/mol\right)\\ \Rightarrow X:Cl;X_2:Cl_2\)

Đáp án C.
Cr có sự tăng số oxi hóa : chất khử, Sn2+ có sự giảm số oxi hóa : chất oxi hóa.