Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án D
0,01 mol A + 0,02 mol HCl ⇒ A có 2 nhóm amino NH2.
0,01 mol A + 0,01 mol NaOH ⇒ A có 1 nhóm cacboxyl COOH.
⇒ A có dạng (H2N)2RCOOH. Chọn đáp án D

Đáp án D
(*) Phương pháp : Amino axit tác dụng với dung dịch axit hoặc bazo
CTTQ: ( N H 2 ) x R ( C O O H ) y . Tìm x,y, R?
Tác dụng dd axit HCL:
![]()
![]()
Tác dụng với dd NaOH:
![]()
![]()
-Lời giải: n N H 2 = n H C l = 0 , 02 m o l
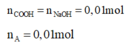
=> Trong 1 nhóm A có 1 nhóm COOH và 2 nhóm N H 2

Đáp án D
nH+ = 0,1(2. CMH2SO4 + CMHCl )= 0,02;
nNaOH = 0,1[CMNaOH + 2CMBa(OH)2] = 0,04.
H+ + OH- " H2O dư 0,02 mol OH-.
[OH-] = 0,02/(0,1+0,1) = 0,1 = 10-1.
[H+] = 10-13 ⇒ pH = 13

Đáp án A
∑ nH+ = 2nH2SO4 + nHCl = 2. 0,1.0,05 + 0,1.0,1 = 0,02 (mol)
∑ nOH- = nNaOH + 2nBa(OH)2 = 0,1.0,2 + 2. 0,1.0,1 = 0,04 (mol)
H+ + OH- → H2O
0,02 → 0,02
=> nOH- dư = 0,04 – 0,02 = 0,02 (mol)
=> [OH-] = n: V = 0,02 : 0,2 = 0,01 M
pH = 14 + log(OH-) = 14 + (-1) = 13

Đáp án A
n HCl = 0,05 (mol)
m muối = m amin + mHCl = 2,9 + 0,05.36,5 = 4,725 (g)

Chọn đáp án A
Phản ứng: KOH + HCl → KCl + H2O
Có nKOH = 0,02 mol; nHCl = 0,01 mol
⇒ sau phản ứng thu được 200 ml dung dịch X gồm 0,01 mol KCl
và 0,01 mol KOH → dung dịch X có môi trường bazơ.
pH = 14 + log([OH−]) = 14 + log(0,01 ÷ 0,2) = 12,7 → chọn đáp án A.
NH3 + HCl -> NH4Cl
NH4Cl -> NH4+ + Cl-
NH4+ <-> NH3 + H+
H+ + OH- <-> H2O
Vì \(Ka\times C>>Kw\) => Bỏ qua nước
NH4+ <-> NH3 + H+
0.1
x x x
0.1-x x x
\(Ka=\dfrac{x^2}{0.1-x}=10^{-9.3}\Leftrightarrow x=7.07\times10^{-6}\)\(\Rightarrow pH=5.2\)
Chọn D