Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

HCHO có cấu tạo theo kiểu H-CO-H, cậu nhận thấy nó có 2 LK C-H; nên khi pư với Br2, nó điền thêm [O] vào các LK C-H đó; vấn đề là nó có thể điền vào 1 nhánh C-H hoặc cả hai nhánh
- Nếu chỉ điền vào một nhánh: tức pư với một phân tử Br2 ==> sp tạo thành là acid focmic:
H-COOH
- Nếu nó điền vào hai lần: tức pư với hai phân tử Br2 ==> sp tạo thành là:
HO-CO-OH = H2CO3 = H2O + CO2

Quy đổi hỗn hợp thành RCOOH
nRCOOH= 2nH2=0,5 mol => nOtrong axit=2nRCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 mol
CO2 + Ba(OH)2---> BaCO3+ H2O
nBa(OH)2=0,7 mol < nCO2 => Ba(OH)2 hết và CO2 dư
=> m Kết tủa = 0,7*(MBaCO3)=137,9 gam.
nCOOH= nNaHCO3=nCO2=0,5 mol => nOtrong axit=2nCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 => mCO2=44

26 gam F gồm Fe2O3 và CuO. Giả sử lúc đầu có x mol Fe và y mol Cu.
56x + 64y = 19,4; 80x + 80y = 26. x = 0,175 và y = 0,15
Hỗn hợp G gồm KOH và KNO3 nên 69,35 gam gồm KOH và KNO2 với số mol lần lượt là a,b mol.
a + b = 0,85; 56a + 85b = 69,35. a = 0,1 và b = 0,75
0,75 mol KNO3 nên số mol e trao đổi = 0,75
Bảo toàn N thì trong Z có 2 khí với tổng N = 0,45 mol.
Số e nhận/số N = 1,677 nên chắc chắn trong đó phải có NO2.
Vì tỷ lệ số mol là 1:2 nên chắc chắn là NO2 phải chiếm 2 phần vì tỷ số trên với các khí NO, N2O, N2 lần lượt là 3, 4 và 5. Và vì tỷ lệ là 2:1 nên chắc chắn phải là NO2 và NO theo như phương pháp trung bình với NO2 là 1, NO là 3, còn trung bình là 1,677. Nếu không, đơn giản là thử với cả 3 khí NO, N2O, N2 xem ai thỏa mãn.
Vậy tổng có 0,45 mol NO và NO2.

Câu 1:
C. H2SO4 loãng; BaCl2; Zn.
Câu 2:
D. Ca(HCO3)2 và MgCl2
Câu 3:
B. 8,96gam
Câu 4:
D. 9,04 gam
Câu 5:
C. Hàm lượng cacbon trong thép từ 2 -3% khối lượng
Câu 6:
D. hematit
Câu 7:
D. Mg, Al, Zn
Câu 8:
B. [Ar]3d54s1
Câu 9:
C. Sắt có tính dẫn điện, dẫn nhiệt tốt và tính nhiễm từ
Câu 10:
A. 4,08
Câu 11:
A. 6,12g
Câu 12:
D. Đun nóng
Câu 13:
B. 0,041
Câu 14:
A. MgO, Al2O3, ,Fe, Cu.
Câu 15:
A. 3,9 gam
Câu 16:
B. Fe, Cu, Cr
Câu 17:
A. Cr(OH)2
Câu 18:
C. Dùng CO khử Al2O3 ở nhiệt độ cao
Câu 19:
B. NaOH.
Câu 20:
C. 5,91g
Câu 21:
C. K
Câu 22:
A. Xuất hiện kết tủa màu xanh, kết tủa không tan và có khí thoát ra.
Câu 23:
A. Cu + O2 + HClà
Câu 24:
A. Điện phân NaCl nóng chảy
Câu 25:
C. Fe2O3, FeCl3
Câu 26:
A. 3
Câu 27:
C. dung dịch Br2
Câu 28:
A. Fe, Al, Zn, Cu
Câu 29:
D. 4

nCO2=4,4822,44,4822,4=0,2mol
MgCO3+ H2SO4 <=> MgSO4 + CO2 + H2O (1)
RCO3 + H2SO4 <=>RSO4 + CO2 +H2O (2)
Theo (1) và (2)=>nMgCO3 +nRCO3=nH2SO4=nCO2=0,2 mol
Khi nung chất rắn B còn khí CO2 thoát ra nên chứng tỏ muối cacbonat còn dư nên xảy ra 1 hoặc 2 phản ứng sau
MgCO3\to\limits^{t^o}\to\limits^{t^o}MgO + CO2 (3)
RCO3\to\limits^{t^o}\to\limits^{t^o} RO + CO2 (4)
Muối cacbonat dư nên H2SO4 hết
CMH2SO4=0,20,50,20,5=0,4M
*Theo (1) và (2) cứ 1 mol muối cacbonat chuyển thành 1 mol muối sunfat(=CO3 =SO4)
Khối lượng tăng:96-60=36g
mà có 0,2 mol muối cacbonat chuyển thành 2 mol muối sunfat nên khối lượng tăng
36.0,2=72
Theo định luật bảo toàn khối lượng có
khối lượng chất rắn B + muối(ddA)=115,3+72
=> khối lượng chất rắn B=115,3+7,2- muối khan A
mB=112,5-12=110,5
từ (3) và (4) => khối lượng C=mB -mCO2
mà nCO2=11,222,411,222,4=0,5mol
=> mCO2=0,5.44=22g
nên mC=110,5-22=88,5g
*Theo (1),(2),(3),(4),ta thấy
nMgCO3 +mRCO3=nCO2=0,2+0,5=0,7
Gọi x là số mol MgCO3 thì số mol RCO3 là 2,5x
x + 2,5x=0,7
=> 3,5x=0,7
=> x= 0,2mol
=> nMgCO3=0,2 mol
và nRCO3=0,2.2,5=0,5mol
mà mMgCO3 + mRCO3=115,3
mMgCO3=84
nên ta có 0,2.84 + 0,5(R + 60)=115,3
=> R=137 đó là kim loại Bari
a./ Các phản ứng xảy ra:
Cho hh 2 muối tác dụng với H2SO4 loãng
MgCO3 + H2SO4 → MgSO4 + H2O + CO2
RCO3 + H2SO4 → RSO4 + H2O + CO2
Số mol khí CO2 sinh ra: n(CO2 1) = 4,48/22,4 = 0,2mol
Nung chất rắn không tan sau pư thấy thoát ra khí CO2 → muối cacbonat dư → H2SO4 đã tham gia phản ứng hết.
Số mol H2SO4 đã dùng: n(H2SO4) = n(CO2) = 0,2mol
Nồng độ dung dịch H2SO4: C(H2SO4) = 0,2/0,5 = 0,4M
b./ Theo ĐL bảo toàn khối lượng:
m(hh muối) + m(H2SO4) = m(muối khan) + m(B) + m(CO2) + m(H2O)
→ m(B) = m(hh muối) + m(H2SO4) - m(muối khan) - m(CO2) - m(H2O) = 115,3 + 0,2.98 - 12.2 - 0,2.44 - 0,2.18 = 110,3g
c./ Số mol CO2 thu được khi nung B: n(CO2 2) = 11,2/22,4 = 0,5mol
Tổng số mol hai muối:
n(hh muối) = n(MgCO3) + n(RCO3) = n(CO2 1) + n(CO2 2) = 0,2 + 0,5 = 0,7mol
n(RCO3) = 2,5.n(MgCO3) → n(MgCO3) = 0,2mol và n(RCO3) = 0,5mol
Khối lượng mỗi muối:
m(MgCO3) = 84.0,2 = 16,8g
m(RCO3) = m(hh muối) - m(MgCO3) = 115,3 - 16,8 = 98,5g
Khối lượng mol phân tử của muối cacbonat cần tìm:
M(RCO3) = R + 60 = m(RCO3)/n(RCO3) = 98,5/0,5 = 197
→ R = 137
Vậy kim loại cần tìm là Ba.

nOH- = 0,04 mol
Vì nAlO2- = 0,02 mol mà chỉ thu được 0,01 mol kết tủa nên nHCl = 4n kết tủa + nAlO2- dư = 0,05 mol
=> tổng nH+ = 0,09 mol => V = 45ml
Vậy : B đúng
H+ + OH- => H2O 1
0,02......0,02
H+ + AlO2 - + H2O => Al(OH)3 2
0,02.....0,02.........................0,02
3H+ + Al(OH)3 => Al3+ +3H2O 3
0,03.........0,01
do cần V lớn nhất nên xét TH tạo kết tủa xong hòa tan 1 phần kết tủa
n Al(OH)3 =0,01 => nAl(OH)3 ở 3 =0,01
=> nHCl= 0,03 +0,02 +0,02 =0,07 => V=0,035 => C

. Chọn A
Dùng quỳ --> nhận biết được CH3NH2
Dùng HNO3 --> albumin ( tạo kt màu vàng )
NaOH --> CH3COONH4 tạo khí mùi khai.
Dùng quỳ tím nhận biết được CH3NH2 (hóa xanh các chất khác không làm đổi màu)
Dùng HNO3 đặc nhận biết albumin (tạo màu vàng)
Dùng NaOH nhận biết CH3COONH4 (tạo khí)
Chú ý: H2NCOOH có tên gọi là axit cacbonic
=> Đáp án A





Đáp án B
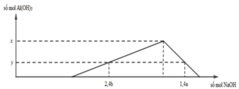
Ta có nH2SO4 = 0,03a mol ⇒ nH+ = 0,06a mol.
nAl2(SO4)3 = 0,3b mol ⇒ nAl3+ = 0,6b mol.
Vì nH+ = 0,6a mol ⇒ nNaOH dùng để trung hòa = 0,6a mol.
⇒ Với 2,4b mol NaOH ta có nAl(OH)3 = 2 , 4 b - 0 , 6 a 3 = y (1).
⇒ Với 1,4a mol NaOH có nAl(OH)3 = 4nAl3+ – nOH– td với Al3+ = 4×0,6b – (1,4a – 0,6a) = y (2).
+ Từ (1) và (2) ⇒ 0,8b – 0,2a = 2,4b – 0,8a
⇔ a b = 1 , 6 0 , 6 = 2 , 667