Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

TN1. nKOH = 0,22 mol
2KOH + ZnSO4 → Zn(OH)2 + K2SO4 (1)
2KOH + Zn(OH)2 → K2ZnO2 + 2H2O (2)
Gọi x là số mol của Zn(OH)2 phản ứng ở pt (2)
ð Số mol của Zn(OH)2 tạo ra ở pt (1) là \(x+\frac{3a}{99}\); nKOH = 2x + \(2\left(x+\frac{3a}{99}\right)\)= 0,22 mol (1')
TN2. nKOH = 0,28 ; Lượng KOH ở thí nghiệm 2 lớn hơn TN1 là 0,28 – 0,22 = 0,06 mol.
Tương tự như trên ta có: nKOH = (2x + 0,06) + \(2\left(x+0,03+\frac{2a}{99}\right)\)= 0,28 mol (2')
Từ (1') và (2') => x = 0,01 ; a = 2,97 ==> nZnSO4 = = 0,1 mol => mZnSO4 = 161.0,1 = 16,1g



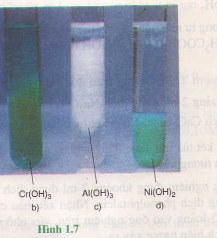
Cr(NO3)3 + 3NaOH(vừa đủ) → Cr(OH)3↓ + 3NaNO3 ;
AlCl3 + 3KOH (vừa đủ) → Al(OH)3↓ + 3KC1 ;
Ni(NO3)2 + 2NaOH → Ni(OH)2↓+ 2NaNO3.
nhìn cái ảnh này là thể hiện tự đăng rồi. Bữa trước môn sinh cũng thế chứ đâu
Đáp án B
• m gam Na + 0,02 mol Al2(SO4)3 → 0,01 mol ↓
• TH1: NaOH hết
2Na + 2H2O → 2NaOH + H2↑
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4
nNa = nNaOH = 0,01 × 3 = 0,03 mol
→ mNa = 0,03 × 23 = 0,69 gam.
• TH2: NaOH dư
2Na + 2H2O → 2NaOH + H2↑ (*)
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4 (**)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (***)
Theo (**) nNaOH = 0,02 × 6 = 0,12 mol; nAl(OH)3 = 0,02 × 2 = 0,04 mol.
Theo (***) nAl(OH)3 phản ứng = 0,04 - 0,01 = 0,03 mol
→ nNaOH = 0,03 mol
→ ∑nNaOH = 0,03 + 0,12 = 0,15 mol → nNa = 0,15 mol
→ mNa = 0,15 × 23 = 3,45 gam