Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi hỗn hợp thành RCOOH
nRCOOH= 2nH2=0,5 mol => nOtrong axit=2nRCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 mol
CO2 + Ba(OH)2---> BaCO3+ H2O
nBa(OH)2=0,7 mol < nCO2 => Ba(OH)2 hết và CO2 dư
=> m Kết tủa = 0,7*(MBaCO3)=137,9 gam.
nCOOH= nNaHCO3=nCO2=0,5 mol => nOtrong axit=2nCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 => mCO2=44

Câu 30: Hỗn hợp M gồm hai axit cacboxylic X và Y (hơn kém nhau một nguyên tử cacbon trong phân tử). Đốt cháy hoàn toàn 0,2 mol M cần vừa đủ V lít O2 (đktc), thu được 0,45 mol CO2 và 0,2 mol H2O. Giá trị của V là
D. 4,48
Note: Nếu bạn muốn hiểu chi tiết lời giải, bạn có thể tham khảo tại đây nha:
Thư viện Đề thi & Kiểm tra

Bảo toàn Na: mol NaOH=2*mol Na2CO3 = 0.06
Bảo toàn khối lượng ==> mH2O = 2,76 + 40*0,06 - 4,44 = 0,72 ==> mol H2O = 0,04
CxHyOz + NaOH ---> muối CxHy-1O2Na + H2O (1)
----a--------0,06----------------------------------0,04
muối CxHy-1O2Na + O2 ----> CO2 + H2O + Na2CO3 (2)
------------------------------------0,11---0,05-----0,03
(1)+(2): CxHyO2Na + NaOH + O2 ----> CO2 + H2O + Na2CO3 (2)
-----------------a------------------------------0,11---0,09-----0,03
mol H: ay + 0,06 = 2*0.09 = 0,18 ===> ay = 0,12
Khi A cháy ==> mol H2O = 0,5ay = 0,06 ==> m H2O = 1,08
Theo bài ra, thu được 4,44g 2 muối + nước
\(\Rightarrow\) 2 x 76 + 0,06 x 40 = 4,44 + m(g) nước
A = CxHyO2
nC = 0,14mol; nH = 0,1 + 0,04 − 0,06 = 0,08
nO = \(\frac{2\times76-m_C-m_H}{16}\) = 0,06
\(\Rightarrow\) Công thức phân tử: C7H6O3.
Đốt cháy thu \(n_{H_2O}\) = 0,02 x 3 = 0,06 mol \(\Rightarrow\) \(m_{H_2O}\) = 0,06 x 18 = 1,08 gam.

Chọn A
Hỗn hợp X gồm 3 chất là ancol metylic, etylen glicol và glixerol, nhưng lại chỉ có một giả thiết nên coi hỗn hợp X chỉ gồm 1 chất là ancol metylic.
Theo bảo toàn nguyên tố C và bảo toàn nguyên tố H trong nhóm -OH, ta có
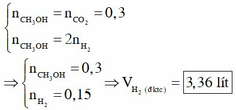

Coi như hỗn hợp X chỉ gồm Na, K, Ba, O
Cho X vào nước thì 3 kim loại phản ứng sinh ra khí H2, còn O tác dụng với H2 để tạo ra nước theo tỷ lệ 1Oxi+1H2
\(\Rightarrow\) \(n_{H_2}=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_O=0,14\left(mol\right)\)
Có \(n_{Na}=n_{NaOH}=0,18\left(mol\right)\)
\(n_K=n_{KOH}=\frac{0,044m}{56};n_{Ba}=n_{Ba\left(OH\right)_2}=\frac{0,93m}{171}\left(mol\right)\)
\(\Rightarrow n_O=\frac{1}{2}n_{Na}+\frac{1}{2}n_K+n_{Ba}-n_{H_2}=0,09+\frac{0,022m}{56}+\frac{0,465m}{171}\)
Lại có phương trình tổng khối lượng hỗn hợp X:
\(m_X=m=m_{Na}+m_K+m_{Ba}+m_O\\ =0,18.23+\frac{0,044m}{56}.39+\frac{0,93m}{171}.137+m_O\)
Thay số mol Oxi tính được (theo m) ở trên vào ta được phương trình 1 ẩn m
giải ra được \(m\approx25,5\)

Số mol H2 = 0,2 mol . số mol Cl2 = 0,175 mol
Đặt số mol Zn,Fe,Cu trong 18,5 g hỗn hợp lần lượt là a,b,c
Ta có phương trình : 65a + 56b + 64c =18,5 (1)
Số mol Zn,Fe,Cu trong 0,15mol hốn hợp lần lượt sẽ là at, bt, ct
Cho hỗn hợp tác dụng với axit HCl ta có phản ứng :
Zn + 2HCl ZnCl2 + H2
a a
Fe + 2HCl FeCl2 + H2
b b
ta có a+b = 0,2 (2)
cho 0,15 mol hốn hợp tác dụng với Cl2 ta cs phương trình phản ứng :
Zn + Cl2 ZnCl2
2Fe + 3Cl2 2FeCl3
Cu + Cl2 CuCl2
Như vậy ta có phương trình : at + bt + ct = 0,175
Với at + bt + ct =0,15
Chia lần lượt 2 vế của 2 phương trình cho nhau ta được
= a -2b + c =0 (3)
Giải hệ phương trình (1),(2),(3) ta thu được a=0,1 . b= 0,1 c= 0,1
tôi ko hiểu chỗ "Số mol Zn,Fe,Cu trong 0,15 mol hỗn hợp lần lượt là at,bt ,ct" giải thích giùm mk đi

Chọn đáp án A.