Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

8. Khi tăng nhiệt độ:
+ Phản ứng CaCO3(s) ⇌ CaO(s) + CO2(g) là phản ứng thu nhiệt nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ, tức chiều thuận.
+ Phản ứng 2SO2(g) + O2(g) ⇌ 2SO3(g) là phản ứng toả nhiệt, khi tăng nhiệt độ, phản ứng chuyển dịch theo chiều giảm nhiệt độ, tức chiều nghịch.
9.
a. Khi tăng nồng độ của C2H5OH, cân bằng chuyển dịch theo chiều thuận, giảm nồng độ của C2H5OH.
b. Khi giảm nồng độ của CH3COOC2H5, cân bằng chuyển dịch theo chiều thuận, tăng nồng độ CH3COOC2H5.

Tác động | Hiện tượng | Chiều chuyển dịch cân bằng (thuận/ nghịch) | Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
Tăng nhiệt độ | Màu dung dịch trong ống nghiệm đậm dần lên | Thuận | Thu nhiệt |
Giảm nhiệt độ | Màu dung dịch trong ống nghiệm nhạt dần đi | Nghịch | Toả nhiệt |
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
CH3COONa + H2O ⇌CH3COOH + NaOH \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\)

Tác động | Hiện tượng | Chiều chuyển dịch cân bằng (thuận/ nghịch) | Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
Tăng nhiệt độ | Màu khí trong ống nghiệm đậm dần lên | Nghịch | Thu nhiệt |
Giảm nhiệt độ | Màu khí trong ống nghiệm nhạt dần đi | Thuận | Toả nhiệt |

10. a) 2SO2(g) + O2(g) ⇌ 2SO3(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều thuận, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
b) CO(g) + H2O(g) ⇌ H2(g) + CO2(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
c) PCl5(g) ⇌ Cl2(g) + PCl3(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ chuyển dịch theo chiều nghịch, tức chiều làm giảm áp suất (hay chiều làm giảm số mol khí).
d) H2(g) + I2(g) ⇌ 2HI(g)
Nếu tăng áp suất và giữ nguyên nhiệt độ, cân bằng sẽ không chuyển dịch, do đối với phản ứng thuận nghịch có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau thì trạng thái cân bằng của hệ không bị chuyển dịch khi thay đổi áp suất chung của hệ.
11.
a)
Cân bằng 1: C(s) + H2O(g) ⇌ CO(g) + H2(g)
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = {\rm{130 kJ > 0}}\)⇒ Chiều thuận thu nhiệt.
Vậy để cân bằng (1) chuyển dịch theo chiều thuận cần tăng nhiệt độ của hệ.
Cân bằng 2: CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
\({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}} = - 42{\rm{ kJ < 0}}\)⇒ Chiều thuận toả nhiệt
Vậy để cân bằng (2) chuyển dịch theo chiều thuận cần giảm nhiệt độ của hệ.
b) Trong thực tế, ở phản ứng (2), lượng hơi nước được lấy dư nhiều (4 – 5 lần) so với khí carbon monoxide. Do:
+ Tăng lượng hơi nước ⇒ cân bằng chuyển dịch theo chiều thuận (tức chiều làm giảm lượng hơi nước) ⇒ tăng hiệu suất thu khí hydrogen.
+ Ngoài ra, hơi nước có giá thành rẻ hơn và không độc hại so với sử dụng lượng dư carbon monoxide.
c) Nếu tăng áp suất cân bằng (1) chuyển dịch theo chiều nghịch. Vì số mol khí của sản phẩm > mol khí tham gia.(2) không thay đổi vì số mol khí của tham gia và sản phẩm bằng nhau
\(K_w=10^{-14}\)
\(\Leftrightarrow\left(H^+\right)\left(OH^-\right)=10^{-14}\)
\(\Rightarrow\left(H^+\right)=\dfrac{10^{-14}}{\left(OH^-\right)}=\dfrac{10^{-14}}{2,5.10^{-10}}=4.10^{-5}\left(M\right)\)
\(\Rightarrow pH=-lg\left(4.10^{-5}\right)\approx4,4\)
Vì \(pH< 7\) nên dung dịch trên có môi trường acid.

Ta có:
| 2SO2 (g) | + | O2 (g) | ⇌ | 2SO3 (g) | |
| Ban đầu (M): | 0,4 | 0,6 | |||
| Phản ứng (M): | 0,3 | 0,15 | 0,3 | ||
| Cân bằng (M): | 0,1 | 0,45 | 0,3 |
⇒ Hằng số cân bằng của phản ứng: Kc = (0,3x0,3) : (0,1x0,1x0,45) = 20KC=[SO3]2[SO2]2[O2]=0,320,12.0,45=20KC=[SO2]2[O2][SO3]2=0,12.0,450,32=20
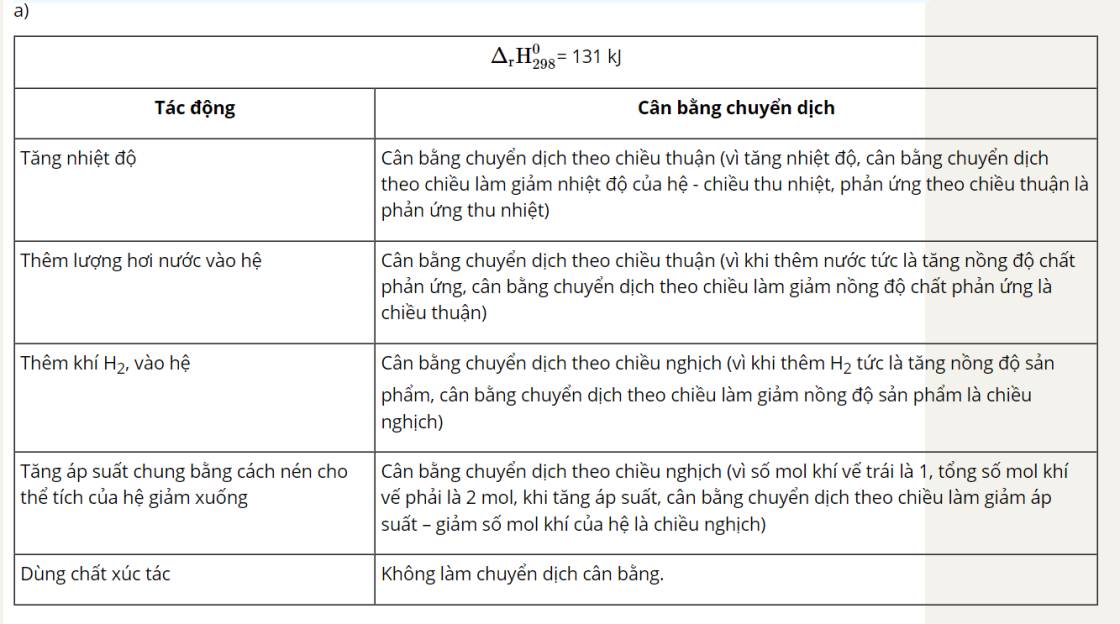
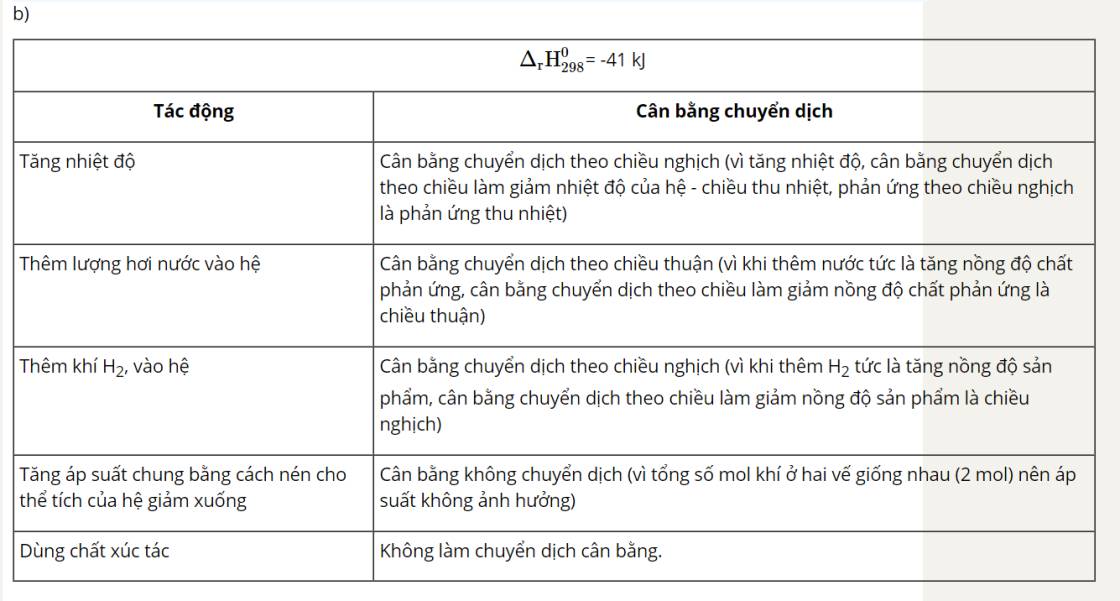


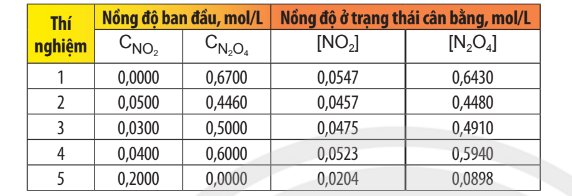
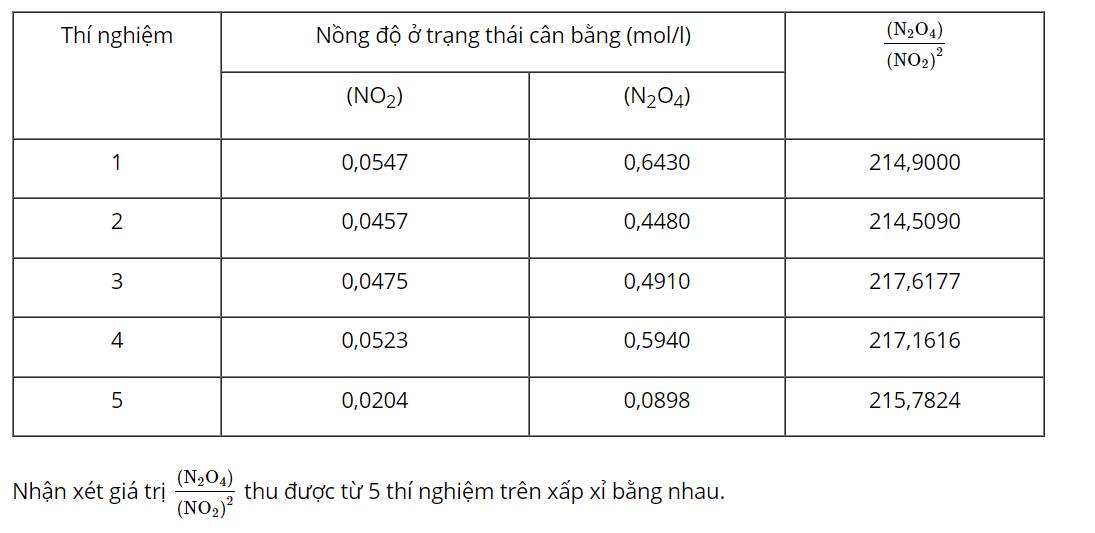
Nhìn delta => Chiều thuận toả nhiệt => Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó, nghĩa là theo chiều giảm nhiệt độ, đó là chiều nghịch (chiều phản ứng thu nhiệt).
Theo chiều thuận: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= -197,8 kJ < 0 → Chiều thuận tỏa nhiệt.
Theo chiều nghịch: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= 197,8 kJ > 0 → Chiều nghịch thu nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm tác động của việc tăng nhiệt độ, nghĩa là cân bằng chuyển dịch theo chiều thu nhiệt (chiều nghịch).