Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

8. Khi tăng nhiệt độ:
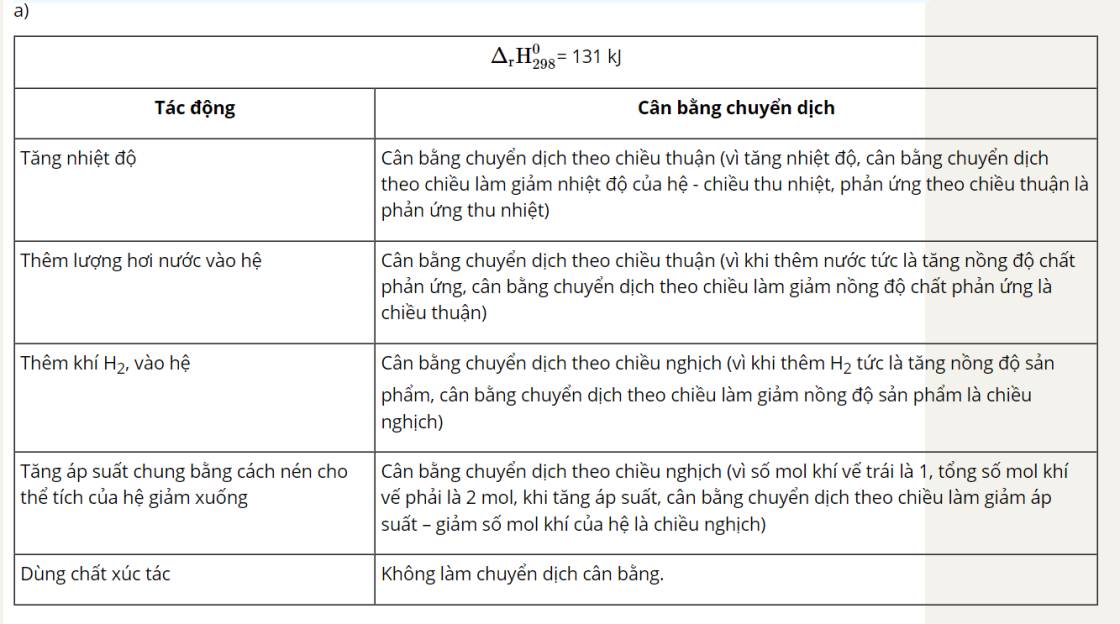
+ Phản ứng CaCO3(s) ⇌ CaO(s) + CO2(g) là phản ứng thu nhiệt nên khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều giảm nhiệt độ, tức chiều thuận.
+ Phản ứng 2SO2(g) + O2(g) ⇌ 2SO3(g) là phản ứng toả nhiệt, khi tăng nhiệt độ, phản ứng chuyển dịch theo chiều giảm nhiệt độ, tức chiều nghịch.
9.
a. Khi tăng nồng độ của C2H5OH, cân bằng chuyển dịch theo chiều thuận, giảm nồng độ của C2H5OH.
b. Khi giảm nồng độ của CH3COOC2H5, cân bằng chuyển dịch theo chiều thuận, tăng nồng độ CH3COOC2H5.

Nhìn delta => Chiều thuận toả nhiệt => Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó, nghĩa là theo chiều giảm nhiệt độ, đó là chiều nghịch (chiều phản ứng thu nhiệt).
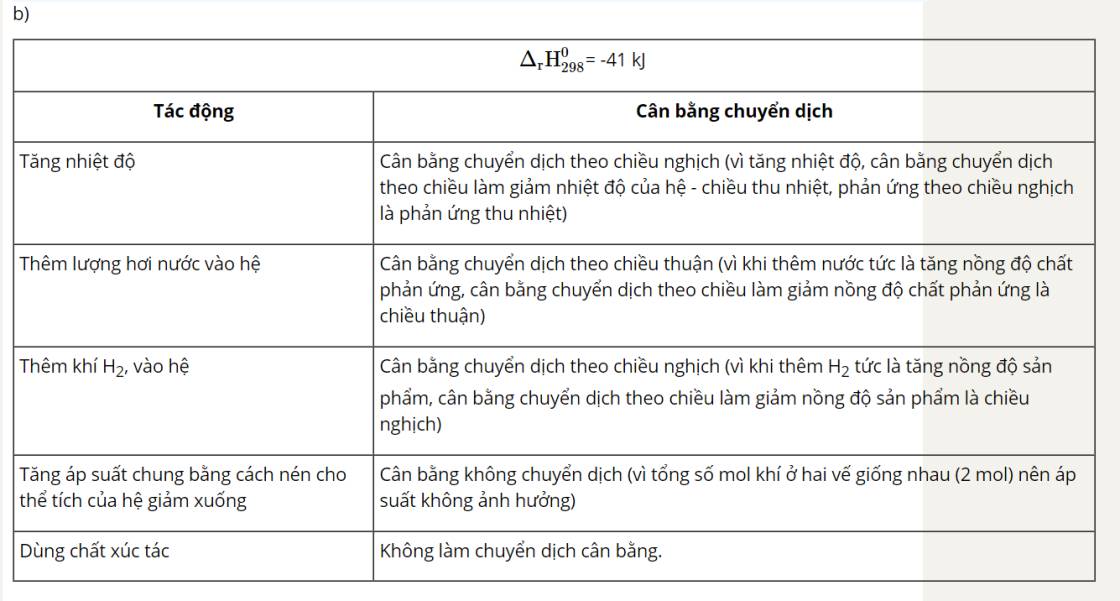
Theo chiều thuận: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= -197,8 kJ < 0 → Chiều thuận tỏa nhiệt.
Theo chiều nghịch: \[{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\]= 197,8 kJ > 0 → Chiều nghịch thu nhiệt.
Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm tác động của việc tăng nhiệt độ, nghĩa là cân bằng chuyển dịch theo chiều thu nhiệt (chiều nghịch).

Tác động | Hiện tượng | Chiều chuyển dịch cân bằng (thuận/ nghịch) | Chiều chuyển dịch cân bằng (toả nhiệt/ thu nhiệt) |
Tăng nhiệt độ | Màu khí trong ống nghiệm đậm dần lên | Nghịch | Thu nhiệt |
Giảm nhiệt độ | Màu khí trong ống nghiệm nhạt dần đi | Thuận | Toả nhiệt |

\(K_w=10^{-14}\)
\(\Leftrightarrow\left(H^+\right)\left(OH^-\right)=10^{-14}\)
\(\Rightarrow\left(H^+\right)=\dfrac{10^{-14}}{\left(OH^-\right)}=\dfrac{10^{-14}}{2,5.10^{-10}}=4.10^{-5}\left(M\right)\)
\(\Rightarrow pH=-lg\left(4.10^{-5}\right)\approx4,4\)
Vì \(pH< 7\) nên dung dịch trên có môi trường acid.

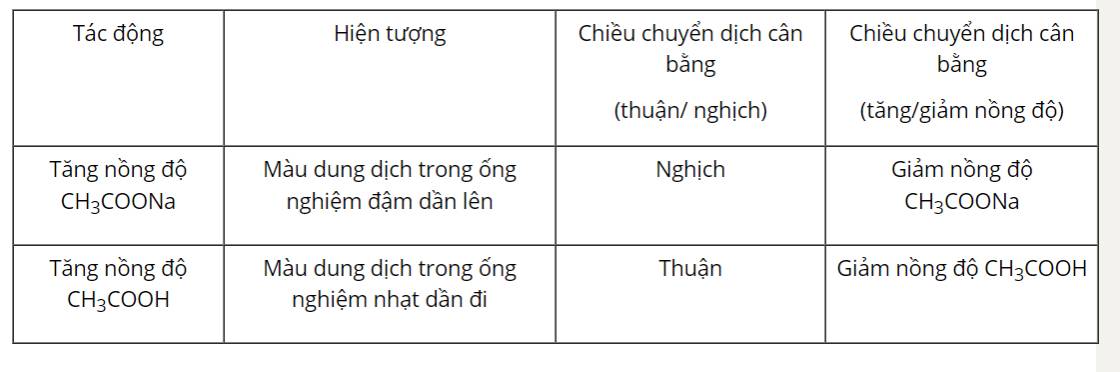
CH3COOH ⇌ CH3COO- + H+
- Khi nhỏ thêm vài giọt NaOH vào dung dịch CH3COOH, NaOH phân li theo phương trình sau:
\({\rm{NaOH}} \to {\rm{N}}{{\rm{a}}^{\rm{ + }}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}}\)
OH- kết hợp với H+ có trong cân bằng (2): \({{\rm{H}}^{\rm{ + }}}{\rm{ + O}}{{\rm{H}}^{\rm{ - }}} \to {{\rm{H}}_{\rm{2}}}{\rm{O}}\)
Vậy khi nhỏ NaOH, lượng H+ trong cân bằng (2) giảm, cân bằng (2) dịch chuyển theo tăng nồng độ H+ (chiều thuận).
- Khi nhỏ thêm vài giọt CH3COONa vào dung dịch CH3COOH, CH3COONa phân li theo phương trình sau:
\({\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{COONa}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{CO}}{{\rm{O}}^{\rm{ - }}}{\rm{ + N}}{{\rm{a}}^{\rm{ + }}}\)
Vậy khi nhỏ thêm vài giọt CH3COONa, lượng CH3COO- trong cân bằng (2) tăng, cân bằng chuyển dịch theo chiều làm giảm lượng CH3COO- (chiều nghịch).

Tác động
Hiện tượng
Chiều chuyển dịch cân bằng
(thuận/ nghịch)
Chiều chuyển dịch cân bằng
(toả nhiệt/ thu nhiệt)
Tăng nhiệt độ
Màu dung dịch trong ống nghiệm đậm dần lên
Thuận
Thu nhiệt
Giảm nhiệt độ
Màu dung dịch trong ống nghiệm nhạt dần đi
Nghịch
Toả nhiệt
Ảnh hưởng của nhiệt độ đến sự chuyển dịch cân bằng:
CH3COONa + H2O ⇌CH3COOH + NaOH \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{o}}{\rm{ > 0}}\)