Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có phương trình cháy
4NH3+3O2->2N2+6H2O
CxHy+(x+y/4)O2->xCO2+(y/2)H2O
Theo dữ kiện bài toán sau khi đốt cháy tạo 100 ml ni tơ
Thực tết thhu được thể tích N2 nhỏ hơn 2 lần hỗn hợp đầu
->V NH3 ban đầu là 100*2=200ml
->V CxHy ban đầu = 100ml
Sau khi đốt tạo 550-250=300 ml CO2
và 1250-550-300=400 ml nước
Có tỉ lệ
CxHy+(x+y/4)O2->xCO2+(y/2)H2O
100------------------300--------400
->x=3
y=8
Vậy CT C3H8

Y gồm \(\left\{{}\begin{matrix}A:a\left(mol\right)\\CO_2:b\left(mol\right)\\H_2O:c\left(mol\right)\end{matrix}\right.\)
Z gồm \(\left\{{}\begin{matrix}A:a\left(mol\right)\\CO_2:b\left(mol\right)\end{matrix}\right.\)
Do nZ = 50%.nY
=> a + b = 0,5a + 0,5b + 0,5c
=> \(c=a+b\)
Khí thoát ra khỏi dd NaOH là khí A
\(n_{CO_2}=83,33\%.n_Z\)
=> b = 0,8333.(a + b)
=> 5a = b
=> Y gồm \(\left\{{}\begin{matrix}A:a\left(mol\right)\\CO_2:5a\left(mol\right)\\H_2O:6a\left(mol\right)\end{matrix}\right.\)
=> nC(A pư) : nH(A pư) = 5a : 12a = 5 : 12
=> CTPT: (C5H12)n
Chọn n = 1 thỏa mãn => CTPT: C5H12

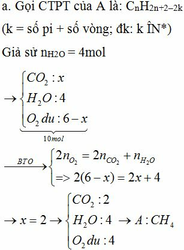
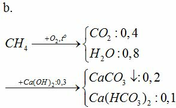
pt:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,3 → 0,3 0,3
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,1 → 0,1 0,1
m dd tăng = mCO2 + mH2O – mCaCO3 = 12g

`a)\ CH_4+2O_2` $\xrightarrow{t^o}$ `CO_2+2H_2O`
`b)`
`M_X=14,4.2=28,8(g//mol)`
`->{n_{CH_4}}/{n_{O_2}}={32-28,8}/{28,8-16}=1/4`
Cho `n_{CH_4}=1(mol)->n_{O_2}=4(mol)`
`CH_4+2O_2` $\xrightarrow{t^o}$ `CO_2+2H_2O`
`1->2->1->2(mol)`
Do `1<4/2->O_2` dư `4-2=2(mol)`
`->Y` gồm `CO_2:1(mol);O_2:2(mol)`
`->M_Y={1.44+2.32}/{1+2}=36(g//mol)`
`->d_{X //Y}={28,8}/{36}=0,8`
đoạn nCH4 với nO2 ở đầu là dùng đường chéo phải không ạ?

a)
\(\left\{{}\begin{matrix}V_{C_2H_2}=x\left(ml\right)\\V_{C_2H_4}=y\left(ml\right)\end{matrix}\right.\)⇒ x + y = 50(1)
\(C_2H_2 +\dfrac{5}{2} O_2 \xrightarrow{t^o} 2CO_2 + H_2O\\ C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O\)
Theo PTHH : 2,5x + 3y = 140(2)
Từ (1)(2) suy ra: x = 20 ; y = 30
Vậy :
\(\%V_{C_2H_2} = \dfrac{20}{50}.100\% = 40\%\\ \%V_{C_2H_4} = 100\% - 40\% = 60\%\)
b)
\(V_{CO_2} = 2V_{C_2H_2} + 2V_{C_2H_4} = 2.50 = 100(ml)\)
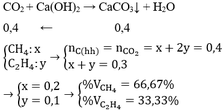
Gọi thể tích O2 phản ứng là : x
O2 + 2H2 -> 2H2O
x -> 2x
\(V_{H2O}\)= V giảm = x + 2x = 100 - 64 = 36
=> x = 12 (ml)
Vì khi thêm 100ml không khí vào hỗn hợp thu đc và làm nổ nên H2 dư, O2 phản ứng hết
Gọi thể tích H2 dư là : y
O2 + 2H2 -> 2H2O
y/2 <- y
\(V_{H2O}\)lần 2 = V giảm = y + y/2 = 64 + 100 - 128 = 36
=> y = 24 (ml)
\(V_{H2}\) trong hỗn hợp = 24 + 12.2 = 48 (ml)
\(\%V_{O2}=\frac{12}{100}.100\%=12\%\)
\(\%V_{H2}=\frac{48}{100}.100\%=48\%\)
\(\%V_{N2}=100\%-12\%-48\%=40\%\)
thanks nha