

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó: n C O 3 2 - = 0 , 0375
Vậy khối lượng chất rắn khan thu được là: m K + + m B a 2 + + m C O 3 2 - + m C l - = 11 , 85 ( g a m )
Đáp án C

Đáp án C
Trong 400 ml dung dịch E có :
![]()
![]()
![]()
⇔ n OH - ban đầu > n OH - / Al OH 3
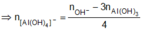
= 0,072 mol
Vậy trong phản ứng của E với dung dịch NaOH đã có hiện tượng hòa tan một phần kết tủa.
Áp dụng bảo toàn điện tích trong dung dịch G, ta có :
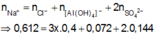
![]()
Suy ra : x:y = 0,21:0,12 = 7:4

Đáp án A
Trong 300 ml dung dịch X có m gam Al 2 SO 4 3 , suy ra trong 150 ml dung dịch X sẽ có 0,5m gam Al 2 SO 4 3 và có số mol là x.
Lượng Al 2 SO 4 3 phản ứng ở 2 thí nghiệm là như nhau. Lượng OH - ở TN2 nhiều hơn ở TN1, lượng kết tủa (y mol) ở TN2 ít hơn ở TN1 (2y mol). Chứng tỏ ở TN2 kết tủa Al OH 3 đã bị hòa tan một phần, ở TN1 kết tủa có thể bị hòa tan hoặc chưa bị hòa tan.
● Nếu ở TN1 kết tủa Al OH 3 chưa bị hòa tan, áp dụng bảo toàn điện tích trong các dung dịch sau phản ứng, ta có :
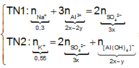
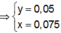
![]() thỏa mãn
thỏa mãn
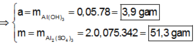
● Ở TN1 kết tủa Al OH 3 đã bị hòa tan, áp dụng bảo toàn điện tích cho dung dịch sau phản ứng, ta có:
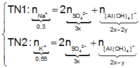
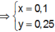
![]() (loại) (*)
(loại) (*)
PS : Nếu không sử dụng biểu thức (*) để biện luận loại trường hợp không thỏa mãn thì sẽ tính ra đáp án B. Nhưng đó là kết quả sai.

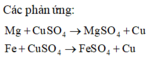
Dung dịch D gồm MgSO4 và FeSO4. Chất rắn B bao gồm Cu và Fe có thể dư
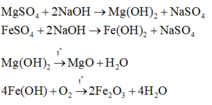
Gọi x, y là số mol Mg và Fe phản ứng. Sự tăng khối lượng từ hỗn hợp A (gồm Mg và Fe) so với hỗn hợp B (gồm Cu và Fe có thể dư) là
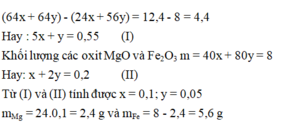
Đáp án C

Hỗn hợp B gồm Cu và Fe dư. nCu = 0,15 mol; nFe = 0,1 - 0,05 = 0,05 mol.
Khi tác dụng với dung dịch HNO3: Theo phương pháp bảo toàn eletron
Chất khử là Fe và Cu
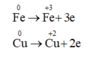
Chất oxi hoá là HNO3
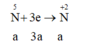
Ta có 3a = 0,15 + 0,3; a = 0,15 (mol),
VNO = 0,15.22,4 = 3,36 (lít)
Đáp án B

Đáp án B
Gọi số mol MgSO4 và Al2(SO4)3 lần lượt là x và y (mol) có trong 200ml dung dịch.
+ 400 ml dd X + NH3 dư => kết tủa thu được là Mg(OH)2 : 2x ( mol) và Al(OH)3: 4y (mol)
=> ∑ mkết tủa = 58.2x + 78.4y = 65,36 (1)
+ 200 ml dd X + Ba(OH)2 dư => kết tủa thu được là Mg(OH)2 : x (mol) và BaSO4 : x + 3y (mol) ( Vì Al(OH)3 tan được trong dd Ba(OH)2 dư)
=> ∑ mkết tủa = 58x + (x + 3y).233 = 151,41 (2)
Từ (1) và (2) => x = 0,16 ; y = 0,15
+ 500 ml dd X ( có 0,4 mol Mg2+, 0,75 mol Al3+) + NaOH→ 70gam kết tủa => lượng NaOH lớn nhất ứng với trường hợp tạo Mg(OH)2↓ và Al(OH)3↓ sau đó kết tủa bị hòa tan 1 phần
=> nAl(OH)3 = (70 – 0,4.58)/78 = 0,6 (mol)
Mg2+ + 2OH → 2Mg(OH)2↓
0,4 → 0,8 (mol)
Al3+ + 3OH-→ Al(OH)3↓
0,75→2,25 → 0,75 (mol)
Al(OH)3+ OH- → AlO2- + 2H2O
(0,75-0,6) → 0,15 (mol)
∑ nOH-= 0,8 + 2,25 + 0,15 = 3,2 (mol) =nNaOH
=> mNaOH = 3,2.40 = 128 (g)