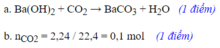Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,CO_2+Ba(OH)_2\to BaCO_3\downarrow+H_2O\\ b,n_{CO_2}=\dfrac{2,24}{22,4}=0,1(mol)\\ \Rightarrow n_{Ba(OH)_2}=0,1(mol)\\ \Rightarrow C_{M_{Ba(OH)_2}}=\dfrac{0,1}{0,2}=0,5M\\ c,n_{BaCO_3}=0,1(mol)\\ \Rightarrow m_{BaCO_3}=0,1.197=19,7(g)\)

Ta có ptpu
MgCO3+ 2HCl ----> MgCl2 + H2O+ CO2
\(n_{MgCO3}\)= \(\frac{9,6}{84}\)= \(\frac{0,8}{7}\) ( mol)
\(m_{HCl}\)= \(\frac{14,6}{100}.100\)= 14,6(g)
=> \(n_{HCl}\)= \(\frac{14,6}{36,5}=0,4\left(mol\right)\)
Theopt ta thấy sau phản ứng HCl dư và dư \(\frac{1,2}{7}\) mol==> m dư= 6,26 (g)
=> \(n_{CO2}\)= \(n_{MgCO3}\)= \(\frac{0,8}{7}\) mol
=> \(V_{CO2}\)= \(\frac{0,8}{7}.22,4=2,56\left(l\right)\)
b)
Ta có \(m_{CO2}\)= \(\frac{0,8}{7}.44=\frac{35,2}{7}\left(g\right)\)
\(m_{H2O}\)= \(\frac{0,8}{7}.18=\frac{14,4}{7}\)( g)
\(m_{MgCl2}\)= \(\frac{0,8}{7}.95=\frac{76}{7}\)(g)
=> \(m_{dd_{MgCl2}}\)= (9,6+100)-( \(\frac{49,6}{7}\))= 102,5(g)
=> \(C\%_{MgCl2}\)= \(\frac{\frac{76}{7}}{102,5}\). 100%= 10,6 ( %)
\(C\%_{HCl_{dư}}\)= \(\frac{6,26}{102,5}.100\)=6,107 ( %)
đề có hơi vô lý một tý nha: hỗn hợp thì phải 2 chất trở lên, nhưng trong đề chỉ có mỗi MgCO3....Đề ghi vậy thì anh làm theo đề nha
mHCl=(14.6*100)/100=14.6g=>nHCl=0.4 mol
nMgCO3=9.6/84=4/35\(\approx\) 0.114mol
theo pthh,HCl dư 2/7 mol=>mHCl dư=73/7g
MgCO3+2HCl --> MgCl2 + CO2+H2O
4/35 0.4 4/35 4/35
a)Vco2=(4/35)*22.4=2.56l
b)C%HCl dư=(73/7)/100*100=76/7\(\approx\) 10.42%
mMgCl2=4/35*95=76.7g
C%MgCl2=(76.7)/100*100=76/7\(\approx\) 10.85%
Chúc em học tốt!!1

Khối lượng riêng \(d=\frac{m}{V}\Rightarrow m=dV\Rightarrow m_{ddNa_2SO_4}=1,55.200=310\left(g\right)\) (*)
\(\begin{cases}m_{CaCl2}=41,6\left(g\right);M_{CaCl2}=111\\mol_{CaCl2}.n_{CaCl2}=\frac{n}{M}=\frac{22,2}{111}=0,2\left(mol\right)\end{cases}\)
Phương trinh:
\(CaCl2+Na_2SO_4\rightarrow CaSO_4\downarrow+2NaCl\)
\(0,02mol\) \(\rightarrow0,02mol\rightarrow0,04mol\)
\(\begin{cases}n_{NaCl}=0,4\left(mol\right);M_{NaCl}=58,5\\m_{CaCl}=m_{dd}=nM=23,4\left(g\right)\end{cases}\) (**)
\(\Rightarrow m_{dd}=m_{ddN\text{à}S\text{\text{O4 } }}+m_{CaCl2}-m_{CaS\text{O4}}\)
Giải hệ thu được: \(m_{CaS\text{O4}}=27,2\left(g\right)\)
Thay (*) (**) (***) \(\Rightarrow m_{dd}=324,4\left(g\right)\)
Vậy nồng độ là" \(7,21\%\)

Gọi công thức oxit của kim loại hóa trị III là A2O3,ta có các phương trình sau
A2O3+3H2SO4--->A2(SO4)3+3H2O (1)
0,02<--0,06<---------0,02
Vì sau phản ứng (1) dung dịch còn có thể phản ứng với CaCO3 giải phóng khí CO2=>axit H2SO4 dư,ta có phương trình
H2SO4+CaCO3--->CaSO4+CO2+H2O (2)
0,01<-----0,01--------0,01<-----0,01
nCO2=0,224:22,4=0,01 mol
Khối lượng muối A2(SO4)3 sau khi cô cạn là
9,36-0,01x(40+96)=8 g
Ta thấy rằng A2O3=3,2 g,sau phản ứng tạo thành muối A2(SO4)3=8g Như vậy khối lượng tăng thêm là do 3 gốc -SO4 thay thế cho 3 nguyên tử Oxi,vậy khối lượng tăng thêm là 8-3,2 =4,8 g
nA2SO4=4,8:(96x3-16x3)=0,02 mol
=>khối lượng muối=0,02x(2xR+96x3)=8
=>R=56
R hóa trị III, có M=56=>R là Fe,công thức oxit là Fe2O3
nH2SO4=0,01+0,06=0,07 mol
mH2SO4=0,07x98=6,86g
Bạn ơi bài này đâu cho hóa trị . Họ cho hoát trị n mà.