Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
nNO=0,18 mol=>ne nhận=ne cho=nNO3- trong muối=3.nNO=0,54 mol
=>mmuối=mKL+mNO3-=17,84+0,54.62=51,32 gam.

Quy đổi oxit sắt gồm có x mol Fe và y mol O
Ta có 56x+16y= 20,88 (1)
Ta có nNO2= 0,29 mol
QT cho e :
Fe → Fe3++ 3e
x 3x mol
QT nhận e :
O+ 2e→ O-2
y 2y mol
N+5+ 1e → NO2
0,29←0,29
Theo ĐL BT electron thì : ne cho= ne nhận nên 3x= 2y+ 0,29 (2)
Từ (1) và (2) ta có x= 0,29 và y= 0,29
Bảo toàn nguyên tố Fe có nFe(NO3)3= nFe= x= 0,29 mol→ mFe(NO3)3=70,18 gam
Đáp án C

Đáp án C
Ta có: nCO= 0,8 mol; nSO2= 0,9 mol
MxOy + yCO → xM + yCO2 (1)
Ta thấy đáp án M là Fe hoặc Cr nên M có số oxi hóa cao nhất là +3
2M + 6H2SO4 → M2(SO4)3+ 3SO2+ 6H2O (2)
Theo PT (2): nM= 2/3.nSO2= 0,6 mol
Theo PT (1):
x y = n M n C O = 0 , 6 0 , 8 = 3 4 => Oxit là F e 3 O 4

Giả sử hỗn hợp gồm Fe (x mol) và O (y mol)
\(n_{NO}=0,09\left(mol\right)\\ m_{hh}=m_{Fe}+m_O\\ \Leftrightarrow56x+16y=17,04\left(1\right)\)
Qúa trình trao đổi e:
\(Fe^0\rightarrow Fe^{+3}+3e\\ O^0+2e\rightarrow O^{-2}\\ N^{+5}+3e\rightarrow N^{+2}\)
Áp dụng ĐLBT e:
\(3n_{Fe}=2.n_O+3.n_{NO}\\ \Leftrightarrow3x=2y+3.0,09\\ \rightarrow3x-2y=0,27\left(2\right)\)
Từ (1), (2) giải được: x=0,24; y=0,225
Bảo toàn nguyên tố Fe:
\(n_{Fe\left(NO_3\right)_3}=n_{Fe}=0,24\left(mol\right)\\ \Rightarrow m_{muối}=m_{Fe\left(NO_3\right)_3}=242.0,24=58,08\left(g\right)\)
Vậy: CHỌN D

\(Cu\rightarrow Cu^{2+}+2e\\ 4H^++NO_3^-+3e\rightarrow NO+20H_2O\\ CuO+HNO_3\rightarrow Cu\left(NO_3\right)_2+H_2O\\ BTe:n_{NO}.3=n_{Cu}.2\\ \Rightarrow n_{Cu}=0,3\left(mol\right)\\ \Rightarrow n_{H^+}=n_{HNO_3\left(pứCu\right)}=0,2.4=0,8\left(mol\right)\\ \Rightarrow n_{HNO_3\left(pứCuO\right)}=1.1-0,8=0,2\left(mol\right)\\ Tacó:n_{CuO}=n_{HNO_3\left(pứCuO\right)}=0,2\left(mol\right)\\ \Rightarrow m=m_{Cu}+m_{CuO}=0,3.64+0,2.80=35,2\left(g\right)\)
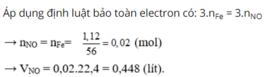




Chọn B