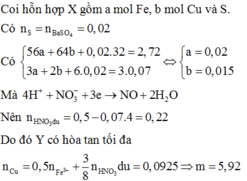Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Thấy Cu không phản ứng với HCl .
\(\Rightarrow m_{cr}=m_{Cu}=6,4\left(g\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
.x.......................................1,5x.........
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
.y....................................y.............
Theo bài ra ta có hệ : \(\left\{{}\begin{matrix}27x+56y+6,4=17,4\\1,5x+y=0,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\) ( mol )
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=5,4\\m_{Fe}=5,6\end{matrix}\right.\) ( g )
b, \(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
.......0,1.........0,2...............................
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
...0,2.......0,6..........................
\(\Rightarrow n_{NaOH}=0,2+0,6=0,8< 1\)
=> Trong B còn có HCl dư .
\(NaOH+HCl\rightarrow NaCl+H_2O\)
...0,2..........0,2....................
=> Dư 0,2 mol HCl .
\(\Rightarrow n_{HCl}=2n_{H_2}+0,2=1\left(mol\right)\)
\(\Rightarrow m_{ddB}=17,4+250-6,4-0,8=260,2\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{HCl}=\dfrac{0,2.36,5}{260,2}.100\%\approx2,8\%\\C\%_{FeCl_2}\approx4,88\%\\C\%_{AlCl_3}\approx10,26\%\end{matrix}\right.\)
Vậy ....

a, Ta có: 24nMg + 56nFe = 9,2 (g) (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
BT e, có: 2nMg + 2nFe = 2nH2 = 0,5 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,15\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,15.24}{9,2}.100\%\approx39,13\%\\\%m_{Fe}\approx60,87\%\end{matrix}\right.\)
b, BTNT H, có: \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,5}{0,2}=2,5\left(M\right)\)

$a)PTHH:2Al+6HCl\to 2AlCl_3+3H_2$
$n_{H_2}=\dfrac{5,04}{22,4}=0,225(mol)$
$\Rightarrow n_{Al}=0,15(mol)$
$\Rightarrow \%m_{Al}=\dfrac{0,15.27}{9,45}.100\%\approx 42,86\%$
$\Rightarrow \%m_{Cu}=100-42,86=57,14\%$
$b)$ Theo PT: $n_{HCl}=2n_{H_2}=0,45(mol)$
$\Rightarrow C_{M_{HCl}}=\dfrac{0,45.110\%}{0,5}=0,99M$

Đặt \(a\) là số mol \(Fe\)
\(b\) là số mol \(Zn\)
\(=> 56a + 65b=30.7\) (1)
\(n\)\(SO2\)=13.44/22.4= 0.6
\(Fe-->Fe\)+3 +3\(e\) \(Zn-->Zn\)+2 +2\(e\) (quá trình nhường \(e\))
\(a\) \(a\) \(3a\) \(b\) \(b\) \(2b\)
\(S\)+6 +2\(e\)-->\(S\)+4 (quá trình nhận \(e\))
0.6 1.2 1.2
áp dụng bảo toàn electron ta có : \(3a + 2b=1.2\) (2)
giải (1) và (2) => \(a=0.2 ; b=0.3\)
%\(n\)\(Fe\)=(0.2/0.2+0.3)x100=40%--> %\(n\)\(Zn\)=60%
b) \(n\)\(SO\)\(2\)/\(n\)\(OH\)=0.6/0.8=0.75<1 => tạo muối \(HSO\)\(3\)
dung dịch sau phản ứng cỉ có \(NaHSO\)3
\(m\)ddspu=1.2*400=480
\(C%\)%\(NaHSO3\)= (104*0.8/480)*100= 17.3%
\(C\)\(M\)=0.8/0.4=2

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

Các PTHH:
Fe + S → FeS (1)
FeS + 2HCl → Fe Cl 2 + H 2 S (2)
Fe(dư) + 2HCl → Fe Cl 2 + H 2 (3)
HCl (dư) + NaOH → NaCl + H 2 O (4)
Nồng độ mol của dung dịch HCL :
Tổng số mol HCL tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCl : 0,2125/0,5 = 0,425 (mol/l)

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 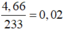 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.