Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn C
Gọi số mol Na, Al và Fe có trong m gam G lần lượt là x, y và z (mol)
Do khi cho G vào nước thu được số mol khí ít hơn khi cho G vào NaOH dư nên khi cho G vào nước dư chỉ có Na phản ứng hết.


Vì X2CO3 tan trong nước nên phải là muối của kim loại kiềm hoặc muối amoni.
Nếu X2CO3 là muối của kim loại kiềm thì gọi
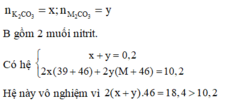
Do đó M2CO3 là (NH4)2CO3 => B chỉ chứa KNO2.
Dễ dàng tính được m = 21,72 (gam)
Đáp án C

Đáp án C
Quy X về N a , A l , O
Y chứa 1 chất tan ⇒ đó là N a A l O 2
Sục CO2 dư vào Y
![]()
B T N T ( A l + N a )
⇒ n N a = n N a A l O 2 = n A l = 0 , 2 m o l
B T e : n N a + 3 n A l = 2 n H 2 + 2 n O
→ n O = 0 , 2 m o l
![]()

Đáp án D
nCO2 = 11,2 :22, 4= 0,5 (mol)
BTNT C: => nCO3 = 0,5 (mol)
Vì KHCO3 và CaCO3 có cùng PTK M= 100 (g/mol) => ∑ nHH = ∑ nCO2 = 0,5 (mol)
=> m = 0,5.100= 50 (g)

Dung dịch E chứa $KOH$ và $K_2CO_3$
Bảo toàn C ta có: $n_{K_2CO_3/(pu)}=0,15(mol)$
Bảo toàn $H^+$ ta có: $n_{KOH/(pu)}=0,1(mol)$
Nhận thấy phản ứng tỉ lệ với nhau là $n_{K_2CO_3}:n_{KOH}=3:2$
Đặt: $n_{K_2CO_3/E}=3a;n_{KOH/E}=2a$
Bảo toàn $OH^-$ ta có: $n_{Ca(OH)_2}=n_{CaCO_3}=a(mol)$
Bảo toàn K ta có: $n_{KHCO_3}=8a(mol)$
$\Rightarrow a=0,1\Rightarrow m=m_{CaCO_3}=10(g)$

Đáp án D
BTNT(C) ⇒ ∑n(KHCO₃, CaCO₃) = nCO₂ = 0,5 mol
Mặt khác, M(KHCO₃) = M(CaCO₃) = 100 ||⇒ m = 0,5 × 100 = 50(g)


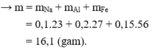
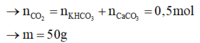
Đáp án B