Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al_2O_3}=\dfrac{10.2}{102}=0.1\left(mol\right)\)
\(n_{HCl}=0.35\cdot2=0.7\left(mol\right)\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(1.................6\)
\(0.1.............0.7\)
Lập tỉ lệ : \(\dfrac{0.1}{1}< \dfrac{0.7}{6}\Rightarrow HCldư\)
\(m_{AlCl_3}=0.1\cdot2\cdot133.5=26.7\left(g\right)\)

nAl = \(\dfrac{m}{M}=\dfrac{5,4}{27}=0,2\) ( mol )
2Al + 6HCl → 2AlCl3 + 3H2
( mol ) 0,2 → 0, 2
\(m_{AlCl_3}=n.M=0,2.\left(27+35,5\times3\right)=26,7\left(g\right)\)
Hoà tan hoàn toàn hh 12,1g Fe và Zn trong 200ml dd HCl 2M vừa đủ. Tính % khối lượng Fe trong hh đầu?

Gọi số mol Fe, Zn là a,b
=> 56a + 65b = 12,1 (1)
PTHH: Fe + 2HCl --> FeCl2 + H2
______a---->2a
Zn + 2HCl --> ZnCl2 + H2
_b---->2b
=> 2a + 2b = 0,4 (2)
(1)(2) => \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
=> \(\%Fe=\dfrac{56.0,1}{12,1}.100\%=46,28\%\)
Đặt \(n_{Fe}=x(mol);n_{Zn}=y(mol)\Rightarrow 56x+65y=12,1(1)\)
\(n_{HCl}=2.0,2=0,4(mol)\\ PTHH:Fe+2HCl\to FeCl_2+H_2\\ Zn+2HCl\to ZnCl_2+H_2\\ \Rightarrow 2x+2y=0,4(2)\\ (1)(2)\Rightarrow x=y=0,1(mol)\\ \Rightarrow \%_{Fe}=\dfrac{0,1.56}{12,1}.100\%=46,28\%\)

Đáp án A
Nhận thấy các đáp án đều là muối X có dạng RHCO3
Ta có mMHCO3 = 0,0625×316= 19,75 gam
2RHCO3 + H2SO4 → R2SO4 + 2CO2 + 2H2O
19,75 gam ------------- 16,5 gam
Gọi số mol của RHCO3 là x mol → mRHCO3 - mR2SO4 =61x-48x= 3,25 → x = 0,25 → MMuối = 79 → MR = 18 (NH4). Loại B,D
Khi phản ứng với HNO3 thì nmuối = nRHCO3= 0,15 mol
→ Mmuối = 47 : 0,025= 188 (NH4NO3.6H2O)
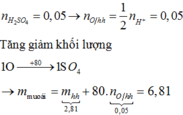
\(n_{Zn}=\dfrac{6,5}{65}=0,1(mol)\\ PTHH:Zn+H_2SO_4\to ZnSO_4+H_2\\ \Rightarrow n_{ZnSO_4}=n_{Zn}=0,1(mol)\\ \Rightarrow m_{ZnSO_4}=0,1.161=16,1(g)\)
Bảo toàn nguyên tố Zn:
\(n_{ZnSO_4}=n_{Zn}=0,1\left(mol\right)\)
\(\Rightarrow m_{ZnSO_4}=16,1\left(g\right)\)