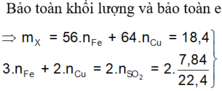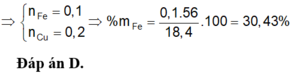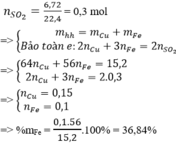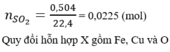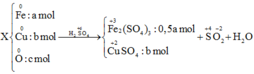Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D.
Gọi nCu = y, nFe = x mol

Áp dụng định luật bảo toàn e ta có: 3x+2y = 0,7 (1)
Khối lượng hai kim loại = 1,84 g: 56x+64y = 184 (2).
Giải 1,2 ta có: x = 0,1, y = 0,2 (mol)
% m F e = 0 , 1 . 56 18 , 4 . 100 % = 30 , 43 %

1) Đặt \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) \(\Rightarrow64a+56b=18,4\) (1)
Ta có: \(n_{SO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Bảo toàn electron: \(2a+3b=0,35\cdot2=0,7\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{0,2\cdot64}{18,4}\cdot100\%\approx69,57\%\\\%m_{Fe}=30,43\%\end{matrix}\right.\)
2) PTHH: \(NaOH+SO_2\rightarrow NaHSO_3\)
Theo PTHH: \(n_{NaOH}=n_{SO_2}=0,35\left(mol\right)\) \(\Rightarrow V_{NaOH}=\dfrac{0,35}{2}=0,175\left(l\right)=175\left(ml\right)\)

\(1) n_{Cu} = a(mol) ; n_{Fe} = b(mol) \Rightarrow 64a + 56b = 18,4(1)\\ n_{SO_2} = \dfrac{7,84}{22,4} = 0,35(mol)\)
Bảo toàn electron :
\(2a + 3b = 0,35.2(2)\\ (1)(2) \Rightarrow a = 0,2 ; b = 0,1\\ \%m_{Cu} = \dfrac{0,2.64}{18,4}.100\% = 69,57\%\\ \%m_{Fe} = 100\%-69,57\% = 30,43\%\\ 2) NaOH + SO_2 \to NaHSO_3\\ n_{NaOH} = n_{SO_2} = 0,35(mol)\\ \Rightarrow V_{dd\ NaOH} = \dfrac{0,35}{2} = 0,175(lít)\)

Đáp án B
nSO2 = 1,7 (mol)
Chất rắn Z là Fe2O3, nFe2O3 = 0,4 (mol)
2Febđ → Fe2O3
0,8 ← 0,4 (mol)
Ta có: mX = 1,7 ×64 – 48=60,8 (gam)

a)
$FeO + 2HCl \to FeCl_2 + H_2O$
$Fe + 2HCl \to FeCl_2 + H_2$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b)
n Fe = n H2 = 4,48/22,4 = 0,2(mol)
n SO2 = 7,84/22,4 = 0,35(mol)
Bảo toàn e :
n FeO + 3n Fe = 2n SO2
=> n FeO = 0,35.2 - 0,2.3 = 0,1(mol)
=> m = 0,1.72 + 0,2.56 = 18,4 gam

Đáp án C
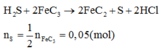
Chú ý: Không tồn tại muối sunfua của Al và Fe(III). H2S không phản ứng với AlCl3 nhưng nếu
![]()
Có sự khác nhau này do Fe3+ có tính oxi hóa mạnh còn Al3+ tính oxi hóa yếu