Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử hợp chất có khối lượng 7g → m M g = 3g ; m S = 4g
Chọn D. Vì:
Theo đề bài: 3g Mg kết hợp vừa đủ với 4g S.
Hoặc 6g Mg kết hợp vừa đủ với 8g S.
Nếu trộn 8g Mg với 8g S thì sẽ sinh ra 14g MgS và còn dư 2g Mg.

Giả sử hợp chất có khối lượng 7g → m M g = 3g ; m S = 4g
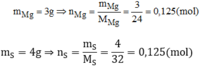
Vậy trong hợp chất: 0,125 mol nguyên tử Mg và 0,125 mol nguyên tử S. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử S.
Nên công thức hóa học đơn giản của magie sunfua: MgS.

21.Thành phần khối lượng của hidro trong nước là:
A.11,1% B.66,7% C.50% D.33,3%
21-2:Thành phần khối lượng của oxi trong hợp chất Magie oxit MgO là:
A.20% B.40% C50% D.60%
21-3:Một hợp chất có thành phần (về khối lượng) của các nguyên tố:75% C, 25% H.Công thức của hợp chất đó là:
A.CH B.CH2 C.CH3 D.CH4
21-4:Một hợp chất có thành phần(về khối lượng) của các nguyên tố:24,4% Ca, 17,1% N,còn lại là O.Công thức của hợp chất đó là(biết MCa=40g)
A.Ca(NO3)2 B.Ca(NO4)2 C.Ca(N2O2)2 D.CaNO3
21-5:Đốt nóng hỗn hợp magie và lưu huỳnh , thu được hợp chất là magie sunfua.Biết 2 nguyên tố kết hợp vs nhau theo tỉ lệ khối lượng là 3 phần Magie vs 4 phần lưu huỳnh
a)công thức hóa học đơn giản cùa magie sunfua
A.MgS2 B.MgS C.Mg3S4 D.Mg2S
b)Nếu trộn 8 g lưu huỳnh rối đốt nóng , sản phẩm sau phản ứng có thành phần là :
A.7g magie sunfua B.8 g Magie C.16g Magie sunfua D.7g Magie sunfua vs 8g lưu huỳnh E.14g Magie và 2g Magie

a)
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
b)
$m_{Mg} + m_{O_2} = m_{MgO}$
c)
$Gọi $m_{Mg} = 3a ; m_{O_2} = 2a$
Ta có: $3a + 2a = 15 \Rightarrow a = 3$
$m_{O_2} = 3.2 = 6(gam)$

a, PT: \(2Mg+O_2\underrightarrow{t^o}2MgO\)
b, mMg + mO2 = mMgO
c, Theo phần b, có: mO2 = 15 - 9 = 6 (g)
Bạn tham khảo nhé!

Goi CT chung là MgxS2.
Ta có pt \(\dfrac{24x}{32\cdot2}=\dfrac{3}{4}\)
Suy ra x = 32*2*3 /4 /24 = 2
Vậy suy ra CT là MgS.
cảm ơn bạn nhiều nha! nhưng đáng lẽ phải là 32x2x2/(4x24) thì mới ra kết quả bằng 2

a: \(2Mg+O_2\rightarrow2MgO\)
\(m_{O_2}=15-9=6\left(g\right)\)
b: \(C+O_2\rightarrow CO_2\)
m=22-16=6(g)
a) CTTQ MgxSy (x,y: nguyên, dương)
Ta có: mMg/ mS= 3/4
<=> 24x/32y=3/4
<=>x/y=1/1
=> CTHH đơn giản: MgS
b) nMg= 1/3 (mol)
nS= 0,25(mol)
PTHH: Mg + S -to-> MgS
Ta có: 1/3 : 1 > 0,25/1
=> Mg dư, S hết, tính theo nS
=> nMgS=0,25(mol) -> mMgS= 56.0,25=14(g)
mMg(dư)= 8 - 0,25.24=2(g)
=> Chọn D