Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử hợp chất có khối lượng 7g → m M g = 3g ; m S = 4g
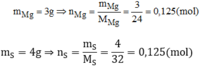
Vậy trong hợp chất: 0,125 mol nguyên tử Mg và 0,125 mol nguyên tử S. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử S.
Nên công thức hóa học đơn giản của magie sunfua: MgS.

Giả sử hợp chất có khối lượng 7g → m M g = 3g ; m S = 4g
Chọn D. Vì:
Theo đề bài: 3g Mg kết hợp vừa đủ với 4g S.
Hoặc 6g Mg kết hợp vừa đủ với 8g S.
Nếu trộn 8g Mg với 8g S thì sẽ sinh ra 14g MgS và còn dư 2g Mg.

a) CTTQ MgxSy (x,y: nguyên, dương)
Ta có: mMg/ mS= 3/4
<=> 24x/32y=3/4
<=>x/y=1/1
=> CTHH đơn giản: MgS
b) nMg= 1/3 (mol)
nS= 0,25(mol)
PTHH: Mg + S -to-> MgS
Ta có: 1/3 : 1 > 0,25/1
=> Mg dư, S hết, tính theo nS
=> nMgS=0,25(mol) -> mMgS= 56.0,25=14(g)
mMg(dư)= 8 - 0,25.24=2(g)
=> Chọn D

\(CTTQ:Fe_xS_y\\ \dfrac{m_{Fe}}{m_S}=\dfrac{56x}{32y}=\dfrac{7}{8}\\ \Rightarrow\dfrac{x}{y}=\dfrac{7}{8}\cdot\dfrac{32}{56}=\dfrac{1}{2}\\ \Rightarrow x=1;y=2\\ \Rightarrow FeS_2\)

Gọi CT của hợp chất: FexSy
Ta có: \(\dfrac{m_{Fe}}{m_S}=\dfrac{56x}{32y}=\dfrac{7}{8}\\ \Rightarrow\dfrac{x}{y}=\dfrac{1}{2}\)
=> CTHH đơn giản: FeS2
\(CTTQ:Fe_xS_y\\ \Rightarrow\dfrac{m_{Fe}}{m_S}=\dfrac{56x}{32y}=\dfrac{7}{8}\\ \Rightarrow\dfrac{x}{y}=\dfrac{7}{8}\cdot\dfrac{32}{56}=\dfrac{1}{2}\\ \Rightarrow x=1;y=2\\ \Rightarrow FeS_2\)

Gọi CTHH cần tìm là: FexOy
\(\dfrac{56x}{32y}=\dfrac{7}{4}\Rightarrow\dfrac{x}{y}=\dfrac{7}{4}.\dfrac{32}{56}=\dfrac{1}{1}\)
\(\Rightarrow\left\{{}\begin{matrix}x=1\\y=1\end{matrix}\right.\\ CTHH:FeS\)

Bài 5) Gọi công thức hoá học của hợp chất là: AlxOy...
Theo đề bài ra ta có:
MAl : MO = 27x : 16y = 4,5 : 4
<=> 72y = 108x => x : y = 2 : 3 ( Chọn x = 2 , y = 3 )
Vậy công thức hoá học của hợp chất là : Al2O3
1) Gọi công thức hóa học của hợp chất là: FexSyOz
Theo đề bài ra ta có:
Khối lượng của Fe trong hợp chất là: 56 . 2 = 112 (g)
Khối lượng của hợp chất là: \(\frac{112.100\%}{28\%}\) = 400 (g)
Khối lượng của nguyên tử S trong hợp chất là: \(\frac{400.24\%}{100\%}\) = 96 (g)
Số nguyên tử S trong hợp chất là: 96 : 32 = 3 (nguyên tử)
Khối lượng của nguyên tử O trong hợp chất là: 400 - 112 - 96 = 192 (g)
Số nguyên tử O trong hợp chất là: 192 : 16 = 12 (nguyên tử)
\(\Rightarrow\) Công thức hóa học của hợp chất là: Fe2(SO4)3

Câu 1 :
\(M_{K_2CO_3}=39.2+12+16.3=138\left(dvC\right)\)
\(\%K=\dfrac{39.2}{138}.100\%=56,52\%\)
\(\%C=\dfrac{12}{138}.100\%=8,69\%\)
\(\%O=100\%-56,52\%-8,69\%=34,79\%\)
Còn lại cậu làm tương tự nhá

\(M_A=\dfrac{1}{\dfrac{0,28}{22,4}}=80\left(g/mol\right)\)
\(m_S=\dfrac{40.80}{100}=32\left(g\right)\Rightarrow n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=80-32=48\left(g\right)\Rightarrow n_O=\dfrac{48}{16}=3\left(mol\right)\)
=> CTHH: SO3
Goi CT chung là MgxS2.
Ta có pt \(\dfrac{24x}{32\cdot2}=\dfrac{3}{4}\)
Suy ra x = 32*2*3 /4 /24 = 2
Vậy suy ra CT là MgS.
cảm ơn bạn nhiều nha! nhưng đáng lẽ phải là 32x2x2/(4x24) thì mới ra kết quả bằng 2