Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nP2O5 = \(\dfrac{49,7}{142}\)= 0.35 (mol)
4P + 5O2 -> 2 P2O5
4 : 5 : 2
0,7 < - 0,35 (mol)
mP = 0,7. 31 = 21,7 (g)
C%mP2O5 = \(\dfrac{21,7}{24,11}.100\%\)\(\approx\)90%

\(PTHH:C+O_2\underrightarrow{t^o}CO_2\)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Từ PTHH ta có
Đốt 1 mol C thì sinh ra 1 mol CO2
=> Đốt 0,3 mol C thì sinh ra 0,3 mol CO2
\(\Rightarrow m_C=0,3.12=3,6\left(g\right)\)
\(\Rightarrow\%C=\dfrac{3,6}{4}=90\%\)
Vậy độ tinh khiết của than là 90%

\(n_{CO_2}=\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_C=n_{CO_2}=0,8\left(mol\right)\)
\(\Rightarrow m_C=0,8.12=9,6\left(g\right)\)
Độ tinh khiết của mẫu C là: \(\dfrac{9,6}{15}.100\%=64\%\)

PTHH: 3Fe + 2O2 → Fe3O4
Số mol của Fe3O4 là: 23,2 : 232 = 0,1 (mol)
Số mol của Fe là: 0,1 . 3 = 0,3 (mol)
Khối lượng Fe nguyên chất tham gia phản ứng là:
0,3 . 56 = 16,8 gam
% tinh khiết của mẩu sắt là: (16,8:21).100% = 80%
Ta có PT:
3Fe + 2O2 ---> Fe3O4
n\(Fe_3O_4\)=\(\frac{23,2}{232}\)=0,1(mol)
Theo PT ta có:
nFe tinh khiết = 3n\(Fe_3O_4\)= 3.0,1=0,3(mol)
mFe tinh khiết = 0,3.56 = 16,8(g)
Độ tinh khiết của sắt đã dùng
= \(\frac{16,8}{21}\).100%=80%

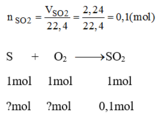
Theo pt: 1 mol S tham gia phản ứng sinh ra 1 mol S O 2
Số mol của lưu huỳnh tham gia phản ứng:
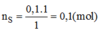
Khối lượng của lưu huỳnh tinh khiết: m S = n S . M S =0,1.32=3,2(g)
Độ tinh khiết của mẫu lưu huỳnh:
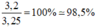

a) $n_P = \dfrac{12,4}{31} = 0,4(mol) ; n_{O_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
$n_P : 4 < n_{O_2} : 5$ nên $O_2$ dư
Điphotpho pentaoxit được tạo thành
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)$
$m_{P_2O_5} = 0,2.142 = 28,4(gam)$
 90 phần trăm
90 phần trăm