Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1:
\(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: C + O2 --to--> CO2
0,15<-----------0,15
=> \(\%C=\dfrac{0,15.12}{2}.100\%=90\%\)
Câu 2:
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,2<-------------------0,3
=> mAl = 0,2.27 = 5,4 (g)
Câu 1.
\(n_{CO_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(C+O_2\underrightarrow{t^o}CO_2\)
0,15 0,15
\(m_C=0,15\cdot12=1,8g\)
\(\%C=\dfrac{1,8}{2}\cdot100\%=90\%\)
Câu 2.
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
0,2 0,3
\(m_{Al}=0,2\cdot27=5,4g\)

X gồm O2 dư và CO2
CO2+ Ca(OH)2 -> CaCO3+ H2O
nCaCO3= nCO2= 0,08 mol
nX= 0,1 mol
=> nO2 dư= 0,02 mol
C+ O2 ⟶ CO2
=> nC= nO2 phản ứng= nCO2= 0,08 mol
Tổng nO2= 0,08+0,02= 0,1 mol
=> V= 2,24l
mC= 0,08.12= 0,96g
Than chứa 96% C nên lượng than đem đốt là 0,96:96%= 1g
Pt thứ 2 có nhiệt độ nha bn:)

Đổi: 24kg = 24000g
24kg than đá có chứa 0,5% tạp chất lưu huỳnh và 1,5% tạp chất khác không cháy được

⇒ nS = 120 / 32 = 3,75 mol
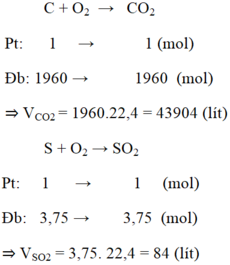

PT: \(C+O_2\underrightarrow{t^o}CO_2\) (1)
\(S+O_2\underrightarrow{t^o}SO_2\) (2)
Ta có: mS = 24.0,5% = 0,12 (kg) = 120 (g) ⇒ nS = 120/32 = 3,75 (mol)
Theo PT (2): \(n_{SO_2}=n_S=3,75\left(mol\right)\)
\(\Rightarrow V_{SO_2}=3,75.22,4=84\left(l\right)\)
Ta có: mC = 24 - 0,12 - 24.1,5% = 23,52 (kg) = 23520 (g)
\(\Rightarrow n_C=\dfrac{23520}{12}=1960\left(mol\right)\)
Theo PT (1): \(n_{CO_2}=n_C=1960\left(mol\right)\)
\(\Rightarrow V_{CO_2}=1960.22,4=43904\left(l\right)\)
Sửa: mC = 23,52 (kg) = 23420 (g)
⇒ \(n_C=\dfrac{23520}{12}=1960\left(mol\right)\)
Theo PT (1): \(n_{CO_2}=n_C=1960\left(mol\right)\)
\(\Rightarrow V_{CO_2}=1960.22,4=43904\left(l\right)\)

\(a.n_{CO_2}=\dfrac{16,8}{22,4}=0,75mol\\ C+O_2\xrightarrow[]{t^0}CO_2\\ n_C=n_{O_2}=n_{CO_2}=0,75mol\\ m_C=0,75.12=9g\)
Độ tinh khiết: \(\dfrac{9}{10}\cdot100\%=90\%\)
\(b.n_{SO_2}=\dfrac{0,56}{22,4}=0,025mol\\ S+O_2\xrightarrow[]{t^0}SO_2\\ n_{O_2}=n_{SO_2}=0,025mol\\ V_{O_2,vừa.đủ}=\left(0,75+0,025\right).24,79=19,21225l\\ V_{O_2.dùng}=19,21225+\dfrac{19,21225.10\%}{100\%}=21,133475l\)

Khối lượng C có trong 1,5 tấn than là: \(m_C=\dfrac{1,5.95}{100}=1,425\) (g)
\(n_C=\dfrac{m}{M}=\dfrac{1,425}{12}=\dfrac{19}{160}\)(mol)
PTHH: C + O2 → CO2
Theo PT: \(n_{O_2}=n_C=\dfrac{19}{160}\)
Khối lượng khí oxi cần dùng là: \(m_{O_2}=n.M=\dfrac{19}{160}.32=3,8\)(g)

\(m_S=0,5\%.24=0,12\left(kg\right)=120\left(g\right)\\ \Rightarrow n_S=\dfrac{120}{32}=3,75\left(mol\right)\\ m_C=1,5\%.24=0,36\left(kg\right)=360\left(g\right)\\ \Rightarrow n_C=\dfrac{360}{12}=30\left(mol\right)\\ S+O_2\rightarrow\left(t^o\right)SO_2\\ C+O_2\rightarrow\left(t^o\right)CO_2\\ n_{SO_2}=n_S=3,75\left(mol\right)\\ \Rightarrow V_{SO_2\left(đktc\right)}=3,75.22,4=84\left(l\right)\\ n_{CO_2}=n_C=30\left(mol\right)\\ \Rightarrow V_{CO_2\left(đktc\right)}=22,4.30=672\left(l\right)\)
(Chắc đề là 1,5% C)

Câu 19:Dùng hết 5kg than (chứa 90% cacbon, 10% tạp chất không cháy) để đun nấu. Thể tích của không khí (ở đktc) đã dùng để đốt cháy lượng than trên là:
A. 4000 lít. B. 42000 lít. C. 4250 lít. D. 4500 lít.
Câu 20: Các chất cho trong dãy đều là oxit :
A. SO2 , CaO, N2O5 , H3PO4, SO3 B.NaOH,HCl,P2O5,SO3,Al2O3
C. SO2 , MgO , P2O5 , K2O , ZnO D.Al2O3,CO2,ZnO,CaCO3,K2O
Câu 21: Trong phòng thí nghiệm cần điều chế 4,48lít O2 (đktc)
Dùng chất nào sau đây để có khối lượng nhỏ nhất :
A. KClO3 B. KMnO4 C. KNO3 D. H2O(điện phân)
Câu 22: Nguyên liệu để sản xuất khí O2 trong công nghiệp là phương án nào sau đây:
A. KMnO4 B. KClO3 C. KNO3 D. Không khí
Câu 23: Chọn định nghĩa phản ứng phân huỷ đầy đủ nhất:
A. Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra một chất mới
B. Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai chất mới
C. Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới
D. Phản ứng phân huỷ là phản ứng hoá học có chất khí thoát ra
Câu 24:Một Oxit của lưu huỳnh, trong đó lưu huỳnh chiếm 40% về khối lượng. Oxit đó là:
A. SO2 B. SO C. SO3 D.
Câu 25:Để oxi hóa hoàn toàn một kim loại M hóa trị II thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. Kim loại M là:
A. Zn. b.Mg C. Ca. D. Ba.
\(PTHH:C+O_2\underrightarrow{t^o}CO_2\)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Từ PTHH ta có
Đốt 1 mol C thì sinh ra 1 mol CO2
=> Đốt 0,3 mol C thì sinh ra 0,3 mol CO2
\(\Rightarrow m_C=0,3.12=3,6\left(g\right)\)
\(\Rightarrow\%C=\dfrac{3,6}{4}=90\%\)
Vậy độ tinh khiết của than là 90%