Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Có các quá trình diễn ra tại các điện cực khi điện phân:

Khi cho X vào dung dịch NaOH ở nhiệt độ thường:
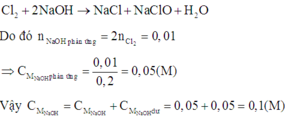

Đáp án D
Vì ở anot có Cl- bị điện phân trước và chỉ thu được một khí duy nhất nên khí đó là Cl2.
⇒ n C l 2 = 0 , 14
Vì cho dung dịch sau điện phân phản ứng với dung dịch NaOH có kết tủa nên Cu2+ chưa bị điện phân hết, khi đó chưa có sự điện phân H+.
Tóm tắt toàn bộ quá trình:
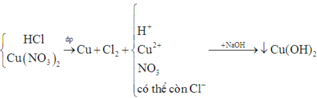
Áp dụng định luật bảo toàn mol electron, ta có: 2nCu = 2 n C l 2 ⇒ n C u = 0,14


Chọn A.
Khí duy nhất thoát ra tại anot là Cl2 (0,14 mol) Þ ne = 0,28 mol Þ nCu = 0,14 mol
Dung dịch sau điện phân chứa Cu2+ dư và H+ (chưa điện phân)
⇒ C u N O 3 2 0 , 02 m o l H C l 0 , 04 m o l
Dung dịch X (tính cho P2) chứa HCl (0,8 mol) và Cu(NO3)2 (0,32 mol)
Khi cho Fe tác dụng với dung dịch trên thì:

Hỗn hợp rắn gồm: 64.0,32 + m – 56.0,62 = 0,75m Þ m = 56,96 (g)

Giải thích: Đáp án C
+ Bình 1: nNaOH=0,0346 mol
Sau khi x mol H2O bị điện phân thì thể tích dung dịch còn lại là 20-18x (ml)
=> CM=0,0346/[(20-18x)/1000] = 2
=> x=0,15
=> ne = 2x = 0,3
Bình 2:
Tại catot:
Cu2+ +2e → Cu
0,15.....0,3
Cu2+ dư 0,225-0,15=0,075 mol
Tại anot:
Cl- -1e → 0,5 Cl2
0,2→0,2
H2O – 2e → 0,5O2 + 2H+
0,1 → 0,1
Dung dịch trong bình 2 sau điện phân gồm: 0,075 mol Cu2+; H+: 0,2+0,1=0,3 mol
Khi cho 0,25 mol Fe vào:
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
Bđ: 0,25 0,3 0,45
Pư: 0,1125← 0,3 →0,075
Sau: 0,1375
Fe + Cu2+ → Fe2+ + Cu
Bđ:0,1375 0,075
Pư:0,075 ← 0,075 →0,075
Sau:0,0625 0,075
=> m chất rắn = 0,0625.56+0,075.64=8,3 gam
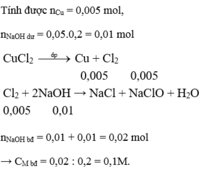



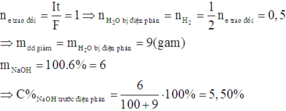
Phản ứng điện phân xảy ra ở các điện cực như sau:
Catot(-): Cu2+ + 2e → Cu; Anot(+): 2Cl- - 2e → Cl2.
Cl2 + 2NaOH → NaCl + NaClO + H2O
Số mol NaOH còn lại sau phản ứng: ns = 0,05.0,2 = 0,01 mol
nCu = 0,32/64 = 0,005 mol → nCl2 = nCu = 0,005 mol → số mol NaOH đã phản ứng: np.ư = 2.nCl2 = 0,01 mol → số mol NaOH ban đầu: nđ = 0,02 mol → CM = 0,02/0,2 = 0,1 M.