Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Bước đầu tiên, cần hoàn thành phương trình phản ứng với đầy đủ các chất và hệ số:
![]()
![]()
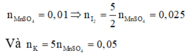
Nhận xét: Ngoài việc viết đầy đủ phản ứng như trên, các bạn vẫn có thể giải quyết bài toán bằng việc áp dụng định luật bảo toàn moi electron và bảo toàn nguyên tố:

Áp dụng định luật bào toàn mol electron, ta có:
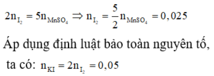

Đáp án B
Bước đầu tiên, cần hoàn thành phương trình phản ứng với đầy đủ các chất và hệ số:
![]()
![]()
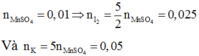
Nhận xét: Ngoài việc viết đầy đủ phản ứng như trên, các bạn vẫn có thể giải quyết bài toán bằng việc áp dụng định luật bảo toàn moi electron và bảo toàn nguyên tố:
Quá trình nhường electron:

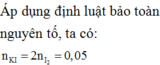

\(Fe^{2+} \to Fe^{3+} + 1e\\ Mn^{+7} + 5e \to Mn^{2+}\\ \Rightarrow n_{Fe^{2+}} = 5n_{KMnO_4} = 0,18.5 =0,9(mol)\\ 2FeCl_3 + Fe \to 3FeCl_2\\ n_{FeCl_3} = \dfrac{2}{3}n_{FeCl_2} = 0,6(mol)\\ n_{Fe\ pư} = \dfrac{1}{3}n_{Fe} = 0,3(mol)\\ \Rightarrow m_{Fe\ trong\ A} = 2,8 + 0,3.56 = 19,6(gam)\\ 2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3\\ n_{Fe} = n_{FeCl_3} = 0,6(mol)\\\)
Phần trăm khối lượng Fe tham gia phản ứng là : \(\dfrac{0,6.56}{0,6.56 + 19,6}.100\% = 63,15\%\)
a ơi nhưng trong đề của cô e cho 4 đáp án không có đáp án 63,15%

1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi \(\rightarrow\) (hỗn hợp oxit ) + axit \(\rightarrow\) muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> \(n_O=\frac{9,6}{16}=0,6mol\)
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 \(\rightarrow\) xM + yH2O (1)
\(n_{H_2}=\frac{985,6}{22,4.1000}=0,044\left(mol\right)\)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl \(\rightarrow\) 2MCln + nH2 (2)
\(n_{H_2}=\frac{739,2}{22,4.1000}=0,033\left(mol\right)\)
(2) => \(\frac{1,848}{M}.n=2.0,033\)
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) \(\frac{x}{y}=\frac{n_M}{n_{H_2}}=\frac{0,033}{0,044}=\frac{3}{4}\)
=> oxit cần tìm là Fe3O4
1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi ![]() (hỗn hợp oxit ) + axit
(hỗn hợp oxit ) + axit ![]() muối + H2O
muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> ![]()
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 ![]() xM + yH2O (1)
xM + yH2O (1)
![]()
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl ![]() 2MCln + nH2 (2)
2MCln + nH2 (2)
![]()
(2) => ![]()
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) ![]()
=> oxit cần tìm là Fe3O4

Chọn A
Số mol MnSO4 = 0,01 mol
Ta có các quá trình: