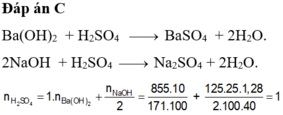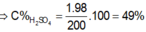Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`a)`
`n_{SO_3}=0,005(mol)`
`m_{H_2SO_4\ 10\%}=10\%.a=0,1a(g)`
`SO_3+H_2O->H_2SO_4`
`0,005->0,005->0,005(mol)`
`->C\%_{H_2SO_4\ sau}={0,005.98+0,1a}/{0,4+a}.100=12,25`
`->a=19,6(g)`
`b)`
`n_{Ba(OH)_2}=0,01.0,5=0,005(mol)`
`n_{H_2SO_4}=0,005+{0,1.19,6}/{98}=0,025(mol)`
`n_{NaOH}=0,05.0,8=0,04(mol)`
`Ba(OH)_2+H_2SO_4->BaSO_4+2H_2O`
`0,005->0,005(mol)`
`->n_{H_2SO_4\ du}=0,025-0,005=0,02(mol)`
`2NaOH+H_2SO_4->Na_2SO_4+2H_2O`
Do `0,02={0,04}/2->` Pu hoàn toàn.
Theo PT : `n_{Na_2SO_4}=n_{H_2SO_4}=0,02(mol)`
`->m_{Na_2SO_4}=0,02.142=2,84<6,44`
`->X` là muối ngậm nước.
Đặt X là `Na_2SO_4.xH_2O`
Bảo toàn Na: `n_{Na_2SO_4.xH_2O}=n_{Na_2SO_4}=0,02(mol)`
`->M_{Na_2SO_4.xH_2O}={6,44}/{0,02}=322(g//mol)`
`->142+18x=322`
`->x=10`
`->X` là `Na_2SO_4.10H_2O`

\(a,n_{H_2SO_4}=1.0,1=0,1(mol)\\ PTHH:2NaOH+H_2SO_4\to Na_2SO_4+2H_2O\\ \Rightarrow n_{naOH}=2n_{H_2SO_4}=0,2(mol)\\ \Rightarrow m_{dd_{NaOH}}=\dfrac{0,2.40}{10\%}=80(g)\\ b,m_{dd_{H_2SO_4}}=1,2.100=120(g)\\ n_{Na_2SO_4}=0,1(mol)\\ \Rightarrow C\%_{Na_2SO_4}=\dfrac{0,1.142}{80+120}.100\%=7,1\%\)

Số mol SO2 và NaOH lần lượt là 0,2 và 0,25.
1 < OH-/SO2=1,25 < 2 ⇒ Dung dịch X chứa hai muối Na2SO3 và NaHSO3.
\(n_{Na_2SO_3}=0,25-0,2=0,05\left(mol\right)\) ⇒ \(n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\).
1. Khối lượng muối có trong X:
m=0,05.126+0,15.104=21,9 (g).
2. Nồng độ mol/l các chất trong X:
\(C_{M\left(Na_2SO_3\right)}\)=0,05/0,2=0,25 (mol/l).
\(C_{M\left(NaHSO_3\right)}\)=0,15/0,2=0,75 (mol/l).
3. Khối lượng kết tủa BaSO3 là:
m'=0,2.217=43,4 (g).

\(n_{BaSO_4}=0,2\left(mol\right)\\ BTNT.S\Rightarrow n_{H_2SO_4}=n_{BaSO_4}=0,2\left(mol\right)\)
\(OH^-+H^+\rightarrow H_2O\)
0,8_____0,8
\(\Rightarrow n_{H^+}=2n_{H_2SO_4}+n_{HCl}\Rightarrow n_{HCl}=0,4\left(mol\right)\)
\(H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl\left(1\right)\)
\(HCl+NaOH\rightarrow NaCl+H_2O\left(2\right)\)
Ta có:
\(n_{H2SO4}=n_{BaSO4}=\frac{46,6}{233}=0,2\left(mol\right)\)
\(\Rightarrow n_{HCl\left(1\right)}=0,4\left(mol\right)\)
\(n_{HCl\left(2\right)}=0,5.1,6=0,8\left(mol\right)\)
\(\Rightarrow n_{HCl}=0,8-0,4=0,4\left(mol\right)\)
\(C\%_{HCl}=\frac{0,4.36,5}{200}.100\%=7,3\%\)
\(C\%_{H2SO4}=\frac{0,2.98}{200}.100\%=9,8\%\)