Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g

(1)
$n_{H_2} = \dfrac{11,2}{22,4} = 0,5(mol)$
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,5 1 0,5 0,5 (mol)
Sau phản ứng : $m_{dd} = 0,5.24 + 100 - 0,5.2 = 111(gam)$
$C\%_{MgCl_2} = \dfrac{0,5.95}{111}.100\% = 42,79\%$
(2)
Trích mẫu thử
Cho dung dịch $H_2SO_4$ tới dư vào mẫu thử :
- mẫu thử tạo khí không màu là $Na_2CO_3$
$Na_2CO_3 + H_2SO_4 \to Na_2SO_4 + CO_2 + H_2O$
- mẫu thử tạo kết tủa trắng là $BaCl_2$
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
- mẫu thử không hiện tượng là $NaNO_3$

\(n_{CaSO_3}=\dfrac{12}{120}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)>n_{CaSO_3}=0,1\left(mol\right)\)
=> Kết tủa bị hòa tan 1 phần
Gọi số mol Ca(OH)2 là x (mol)
PTHH: Ca(OH)2 + SO2 --> CaSO3 + H2O
x-------->x-------->x
CaSO3 + SO2 + H2O --> Ca(HSO3)2
(x-0,1)-->(x-0,1)
=> x + (x-0,1) = 0,4
=> x = 0,25
=> \(V=\dfrac{0,25}{0,05}=5\left(l\right)\)


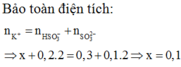

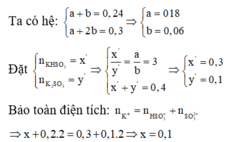


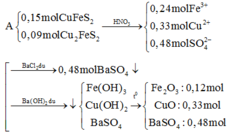
Số mol SO2 và NaOH lần lượt là 0,2 và 0,25.
1 < OH-/SO2=1,25 < 2 ⇒ Dung dịch X chứa hai muối Na2SO3 và NaHSO3.
\(n_{Na_2SO_3}=0,25-0,2=0,05\left(mol\right)\) ⇒ \(n_{NaHSO_3}=0,2-0,05=0,15\left(mol\right)\).
1. Khối lượng muối có trong X:
m=0,05.126+0,15.104=21,9 (g).
2. Nồng độ mol/l các chất trong X:
\(C_{M\left(Na_2SO_3\right)}\)=0,05/0,2=0,25 (mol/l).
\(C_{M\left(NaHSO_3\right)}\)=0,15/0,2=0,75 (mol/l).
3. Khối lượng kết tủa BaSO3 là:
m'=0,2.217=43,4 (g).
Thank you bạn